
【题目】苯甲酸广泛应用于制药和化工行业,某同学尝试用甲苯的氧化反应制备苯甲酸。
Ⅰ.制备苯甲酸和回收未反应的甲苯
反应原理:

第1步:一定量的甲苯和KMnO4溶液在100℃反应一段时间后停止反应;
第2步:过滤反应混合物,得到滤液;经过操作Ⅰ,得到有机层和水层;
第3步:向有机层中加无水Na2SO4,过滤,经过操作Ⅱ,得到无色液体A;
第4步:向水层加入浓盐酸酸化,蒸发浓缩,冷却,过滤,得到白色固体B;
已知:
相对分子质量 | 熔点 | 沸点 | 密度 | 溶解度 | |
甲苯 | 92 | -95℃ | 110.8℃ | 0.8669g·mL-1 | 极微溶于水 |
苯甲酸 | 122 | 122.4℃ | 249℃ | 1.2659 g·mL-1 | 0.3g (25℃时) 6.9g (95℃时) |
(1)操作Ⅰ所用的玻璃仪器有烧杯和______________,操作Ⅱ为________________。
(2)第3步中加入无水Na2SO4的目的是_____________________,无色液体A是_______。
Ⅱ.提纯粗苯甲酸
该同学利用重结晶的方法对得到的B进行提纯。重结晶的过程:加热溶解→趁热抽滤→冷却结晶→抽滤→洗涤→干燥→纯苯甲酸。(注:抽滤装置如图所示,主要仪器有A布氏漏斗,B抽滤瓶,抽气泵等)

(3)白色固体B中的杂质是____________。
(4)趁热抽滤得到的滤液放置冷却可以结晶出纯净的苯甲酸晶体,为了得到更多的苯甲酸,是不是温度越低越好并说明理由______(填“是”或“不是”),理由__________________________________________________________。
(5)使用抽滤装置比普通过滤装置的优点是_______________________________________。
(6)实验中取甲苯10.0 mL,制得苯甲酸8.0g,本次实验中苯甲酸的产率为____________(结果保留到小数点后一位)。
【答案】 分液漏斗 蒸馏 干燥有机层 甲苯 氯化钾(或KCl) 不是 温度太低杂质溶解度降低,杂质可能析出,使产物不纯 抽滤能加快过滤的速度 69.6%
【解析】⑴. 经过操作I,可以得到有机层和水层,分离互不相溶的液体采用分液法,即操作I为分液,分液时所用的玻璃仪器有烧杯和分液漏斗,向有机层中加无水Na2SO4,过滤,经过操作II,得到无色液体A,因有机层中的物质互溶且沸点不同,所以可采用蒸馏的方法进行分离,即操作II为蒸馏,故答案为:分液漏斗;蒸馏;
⑵. 第3步中加入无水Na2SO4,可以吸收有机物中含有的少量水,再经过蒸馏得到无色液体甲苯,故答案为:干燥有机层;甲苯;
II. ⑶. 根据题中所给反应原理可知,水层中含有苯甲酸钾,向水层加入浓盐酸酸化,生成苯甲酸和KCl,蒸发浓缩,冷却,过滤,得到的白色固体B为苯甲酸,苯甲酸中含有的杂质是KCl,故答案为:氯化钾(或KCl);
⑷. 若温度过低,杂质会因溶解度降低而析出,使得到的苯甲酸不纯,故答案为:不是;温度太低杂质溶解度降低,杂质可能析出,使产物不纯;
⑸. 抽滤与过滤相比,抽滤的速度快、效果好,故答案为:抽滤能加快过滤的速度;
⑹.实验中取甲苯10.0 mL,甲苯的物质的量为:10mL×0.8669g/mL÷92g/mol=0.094mol,根据反应方程式可知,1mol甲苯可制得1mol苯甲酸,则理论上可制得苯甲酸的质量为0.094mol×122g/mol=11.5g,现实际制得苯甲酸8.0g,则本次实验中苯甲酸的产率为:![]() ×100%=69.6%,故答案为:69.6%。
×100%=69.6%,故答案为:69.6%。


 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案科目:高中化学 来源: 题型:
【题目】锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是( )

A. 铜电极上发生氧化反应
B. 电池工作一段时间后,甲池的C(SO42-)减小
C. 电池工作一段时间后,乙池溶液的总质量增加
D. 阳离子通过交换膜向正极移动,阴离子通过交换膜向负极移动,保持溶液中电荷平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)科学家可以通过__________法发现太阳存在有大量的铁元素,写出基态Fe原子的价电子排布图__________________。从结构上分析Fe3+比Fe2+稳定的原因:________________________。
(2)SCN-常用来检测Fe3+的存在,SCN-中心原子的杂化方式为_________,三种元素电负性由大到小的顺序为__________________。
(3)砷化镓以第三代半导体著称,熔点为1230℃,具有空间网状结构。已知氮化硼与砷化镓属于同种晶体类型。则两种晶体熔点较高的是_________(填化学式),其理由是________________________。
(4)C60分子又名足球烯,它是由60个碳原子组成的球状分子,右图为C60结构图。一个C60分子中六元环的数目为____________,在C60晶胞中C60分子的配位数为___________。已知C60分子的球体 半径为a nm,求C60晶体的ρ=_________g/cm3。(用NA表示阿伏加德罗常数,写出表达式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,下列说法不正确的是 ( )

A. 图Ⅰ表示向AlCl3溶液中滴加氨水至过量
B. 图Ⅱ表示向NaOH溶液中滴加AlCl3溶液至过量且边滴边振荡
C. 图Ⅲ表示向NaAlO2溶液中滴加稀盐酸至过量且边滴边振荡
D. 图Ⅳ表示向NaAlO2溶液中缓慢通入二氧化碳至过量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家开发出一种“洁净煤技术”,通过向地下煤层“气化炉”中交替鼓入空气和水蒸气的方法,连续产出高热值的煤炭气,其主要成分是CO和H2。“气化炉”中主要反应有:C(s)+ +H2O (g) =CO(g)+H2(g) △H= +131.3 kJmol-1
CO(g)+H2O(g) =CO2(g)+H2(g) △H= — 41.2kJmol-1
(1)气化炉中CO2与C反应转化为CO,该反应的热化学方程式是 __________________________________。
(2)用煤炭气合成甲醇的反应为CO(g)+2H2(g) ![]() CH3OH(g)。在密闭容器中,将CO和H2按物质的量1:2混合反应,CO的平衡转化率与温度、压强的关系如右图所示:
CH3OH(g)。在密闭容器中,将CO和H2按物质的量1:2混合反应,CO的平衡转化率与温度、压强的关系如右图所示:
①生成甲醇的反应为_______(填“放热”或“吸热”)。
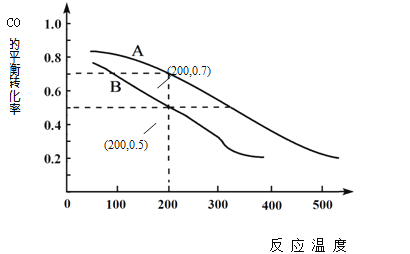
②图中两条曲线分别表示压强为0.1MPa和5.0MPa下CO转化率随温度的变化,其中代表压强是5.0MPa的曲线是____________(填“A”或“B”)。
③在不改变反应物用量的前提下,为提高CO转化率可采取的措施有 _______________________ 。
④压强为0.1MPa、温度为200℃时,平衡混合气中甲醇的物质的量分数是 _______________。
(3)某新型电池以熔融碳酸盐作电解质,在650℃下工作,负极通入煤炭气,正极通入空气与CO2的混合气.电池的正极反应式为O2+2CO2+4e-=2CO32—,负极反应式为 ___________________和_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语表达正确的是( )
①丙烷的球棍模型: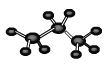
②丙烯的结构简式为:CH3CHCH2
③![]() 的化学式为C8H12
的化学式为C8H12
④一氯甲烷和二氯甲烷、乙烯和苯乙烯互为同系物
⑤![]() 与C8H6互为同分异构体
与C8H6互为同分异构体
⑥石油是混合物,其分馏产品煤油为纯净物
A. ①③④⑤ B. ①③ C. ②④⑥ D. ①②
查看答案和解析>>
科目:高中化学 来源: 题型:
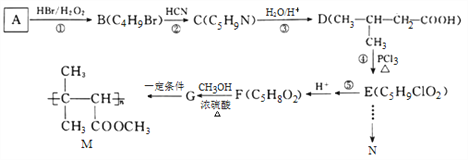
【题目】有机物N(![]() )是一种常见的有机合成中间体,在生产中用途广泛。以有机物A为原料合成M和N的路线如下所示:
)是一种常见的有机合成中间体,在生产中用途广泛。以有机物A为原料合成M和N的路线如下所示:
已知:I. ![]()
II. ![]()
请回答下列问题:
(1)A分子中共面的原子数最多为________个,-CN的电子式为_______________。
(2)②的反应类型为________________, E分子中所含官能团的名称为____________,G的结构简式为_____________________。
(3)写出反应⑤的化学方程式__________________________________________,写出M在酸性条件下水解的化学方程式_________________________________。
(4)D的同分异构体中,能发生银镜反应,且能与钠反应放出H2的共有______种,写出核磁共振氢谱有4组峰,且峰面积比为1:1:2:6的一种同分异构体的结构简式:____________________。
(5)结合信息,写出用E和乙醇为原料制备化合物N的合成路线:(其他试剂任选)_____________
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为教科书中电解饱和食盐水的实验装置。据此,下列叙述不正确的是
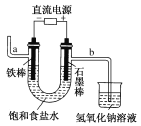
A. 装置中a管能产生氢气
B. b管导出的是氯气
C. 在石墨棒电极区域有NaOH生成
D. 以电解食盐水为基础制取氯气等产品的工业称为“氯碱工业”
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在生产和日常生活中有着重要的应用.下列说法不正确的是( )
A.工业上可用铝热反应大规模炼铁
B.SO2常用于纸张等植物纤维的漂白
C.Si是重要的半导体材料
D.电解熔融MgCl2 , 可制得金属镁
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com