
分析 (1)①CH3OH(g)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-764.5kJ•mol-1
②CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0kJ•mol-1
③H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8kJ•mol-1
由盖斯定律可知,②+③×2-①得到CO(g)+2H2(g)?CH3OH(g);
(2)增大浓度、温度,使用催化剂均可加快反应速率;
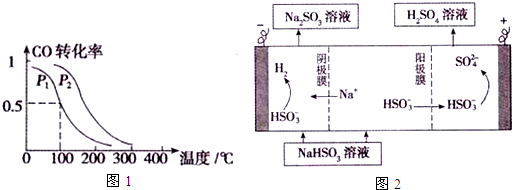
(3)①相同温度下,同一容器中,增大压强,平衡向正反应方向移动,则CO的转化率增大;
②该温度下,平衡时n(CO)=amol×(1-0.5)=0.5amol,n(CH3OH)=c(CO)(参加反应)=amol×0.5=0.5amol,n(H2)=2amol-2×amol×0.5=amol,则c(CO)=$\frac{0.5a}{V}$mol/L、c(CH3OH)=$\frac{0.5a}{V}$mol/L、c(H2)=$\frac{a}{V}$mol/L,化学平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO){c}^{2}({H}_{2})}$;
③向容器中通入CO、H2、CH3OH各0.5amol,Qc=$\frac{\frac{0.5a}{V}}{\frac{0.5a}{V}×(\frac{0.5a}{V})^{2}}$,与K比较,判断反应进行的方向;
(4)用SO2和H2O来制备硫酸,负极上二氧化硫失去电子生成硫酸;
(5)若混合前Na2SO3溶液的浓度为2×10-3mol•L-1,等体积混合后浓度为10-3mol•L-1,结合Ksp计算;由图可知电解产物,以此书写电解方程式.
解答 解:(1)①CH3OH(g)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-764.5kJ•mol-1
②CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0kJ•mol-1
③H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8kJ•mol-1
由盖斯定律可知,②+③×2-①得到CO(g)+2H2(g)?CH3OH(g)△H=(-283.0kJ•mol-1)+(-285.8kJ•mol-1)×2-(-764.5kJ•mol-1)=-90.1kJ/mol,
故答案为:-90.1;
(2)a.使用催化剂,可加快反应速率,故选;
b.降低反应温度,反应速率减小,故不选;
c.增大体系压强,反应速率加快,故选;
d.不断将CH3OH从反应混合物中分离出来,平衡虽正向移动,但浓度减小、反应速率减小,故不选;
故答案为:ac;
(3)①相同温度下,同一容器中,增大压强,平衡向正反应方向移动,则CO的转化率增大,根据图象知,p1小于p2,
故答案为:小于;
②该温度下,平衡时n(CO)=amol×(1-0.5)=0.5amol,n(CH3OH)=c(CO)(参加反应)=amol×0.5=0.5amol,n(H2)=2amol-2×amol×0.5=amol,则c(CO)=$\frac{0.5a}{V}$mol/L、c(CH3OH)=$\frac{0.5a}{V}$mol/L、c(H2)=$\frac{a}{V}$mol/L,化学平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO){c}^{2}({H}_{2})}$=$(\frac{V}{a})^{2}$,
故答案为:$(\frac{V}{a})^{2}$;
③向容器中通入CO、H2、CH3OH各0.5amol,Qc=$\frac{\frac{0.5a}{V}}{\frac{0.5a}{V}×(\frac{0.5a}{V})^{2}}$>K=$(\frac{V}{a})^{2}$,则平衡向左移动,
故答案为:向左;
(4)该原电池中,负极上失电子被氧化,二氧化硫到硫酸,硫的化合价升高,所以负极上投放的气体是二氧化硫,二氧化硫失电子和水反应生成硫酸根离子和氢离子,所以负极上的电极反应式为:SO2-2e-+2H2O═SO42-+4H+,
故答案为:SO2-2e-+2H2O═SO42-+4H+;
(5)若混合前Na2SO3溶液的浓度为2×10-3mol•L-1,等体积混合后浓度为10-3mol•L-1,生成沉淀所需CaCl2溶液的最小浓度为$\frac{3.1×1{0}^{-7}}{1{0}^{-3}}$mol/L×2=6.2×10-4mol•L-1;电解池中阳极和电源正极相连,失去电子,发生氧化反应,电解NaHSO3溶液可制得硫酸,硫的化合价升高,所以阳极是HSO3-溶液失去电子被氧化生成SO42-,阳极电极反应式为HSO3-+H2O-2e-=SO42-+3H+,阴极上得到电子生成氢气,电解反应为2NaHSO3+H2O$\frac{\underline{\;电解\;}}{\;}$Na2SO3+H2SO4+H2↑,
故答案为:6.2×10-4mol•L-1;2NaHSO3+H2O$\frac{\underline{\;电解\;}}{\;}$Na2SO3+H2SO4+H2↑.
点评 本题考查较综合,涉及化学平衡计算、反应热的计算、Ksp的计算及电解等,为高频考点,把握盖斯定律应用、图象及平衡移动原理的结合、K与Qc及Ksp为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料 | |
| B. | “青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于物理变化 | |
| C. | 在食品袋中放入盛有硅胶和铁粉的透气小袋,分别可防止食物受潮、氧化变质 | |
| D. | 采用“静电除尘”“燃煤固硫”、“汽车尾气催化净化”可提高空气质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | 1760℃ | 2400℃ | 2730℃ |
| 平衡常数 | 2.4×10-4 | 6.4×10-3 | 8.9×10-3 |
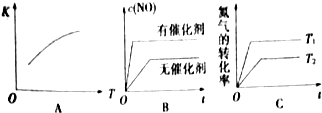
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/10-4mol/L | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(CO)/10-3mol/L | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaNO2是还原剂 | B. | 生成1个N2时转移的电子数为6个 | ||
| C. | NH4Cl中的N元素被还原 | D. | N2既是氧化产物又是还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③ | B. | ②④ | C. | ③④ | D. | ①③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com