
| 名称 | 相对分子质量 | 性状 | 熔点 | 沸点 | 密度 | 溶解度 | ||
| 水 | 乙醇 | 乙醚 | ||||||
| 甲苯 | 92 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8669 | 不溶 | ∞ | ∞ |
| 苯甲酸 | 122 | 白色片状或针状晶体 | 122.4 | 248 | 1.2659 | 微溶 | 易溶 | 易溶 |
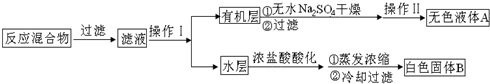
 .操作Ⅱ为蒸馏.
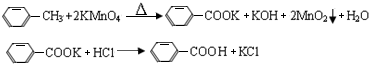
.操作Ⅱ为蒸馏.分析 一定量的甲苯和适量的KMnO4溶液在100℃反应一段时间后停止反应,按如图流程分离出苯甲酸和回收未反应的甲苯,苯甲酸能溶于水,甲苯不溶于水,互不相溶的液体采用分液方法分离,根据实验目的知,从而得到有机层和水层,有机层中含有甲苯、水层中含有苯甲酸,有机层中的甲苯采用蒸馏方法得到无色液体A,A是甲苯,将水层盐酸酸化再蒸发浓缩,根据苯甲酸的溶解度知,得到的固体B是苯甲酸,
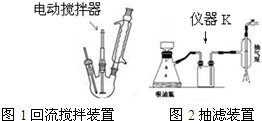
(1)由装置图分析图2仪器K为安全瓶;A是甲苯;分离互溶且沸点不同的液体采用蒸馏方法;
(2)如果滤液呈紫色,说明高锰酸钾过量,要先加亚硫酸氢钾,将高锰酸钾还原,否则浓盐酸可能被氧化成氯气;
(3)A.抽滤时,瓶中压强较小,可以加快过滤速度;
B.为了防止搅拌棒下端打坏三颈烧瓶底或温度计,因此不能与它们接触;
C.抽滤结束后,先断开真空系统与过滤系统的连接,再关闭水龙头;
D.冷凝管中水的流向与蒸汽的流向相反;
(4)甲苯与NaOH不反应,苯甲酸与NaOH反应生成苯甲酸钠,分液,苯甲酸钠溶液中加盐酸可以制得苯甲酸;
(5)苯甲酸和KOH溶液发生酸碱中和反应,根据苯甲酸和KOH之间的关系式计算苯甲酸的质量,从而计算苯甲酸的质量分数.
解答 解:一定量的甲苯和适量的KMnO4溶液在100℃反应一段时间后停止反应,按如图流程分离出苯甲酸和回收未反应的甲苯,苯甲酸能溶于水,甲苯不溶于水,互不相溶的液体采用分液方法分离,根据实验目的知,从而得到有机层和水层,有机层中含有甲苯、水层中含有苯甲酸,有机层中的甲苯采用蒸馏方法得到无色液体A,A是甲苯,将水层盐酸酸化再蒸发浓缩,根据苯甲酸的溶解度知,得到的固体B是苯甲酸,
(1)由装置图分析图2仪器K为安全瓶;A是甲苯,其结构简式为: ;有机层中物质互溶且沸点不同,所以可以采用蒸馏方法分离,则操作II为蒸馏
;有机层中物质互溶且沸点不同,所以可以采用蒸馏方法分离,则操作II为蒸馏
故答案为:安全瓶; ;蒸馏;
;蒸馏;
(2)如果滤液呈紫色,说明高锰酸钾过量,要先加亚硫酸氢钾,除去未反应的高锰酸钾,否则浓盐酸酸化时可能被高锰酸钾氧化成氯气,
故答案为:除去未反应的高锰酸钾,否则用盐酸酸化时会发生盐酸被高锰酸钾所氧化,产生氯气;
(3)A.抽滤时,瓶中压强较小,可以加快过滤速度,得到较干燥的沉淀,故A正确;
B.为了防止搅拌棒下端打坏三颈烧瓶底或温度计,因此不能与它们接触,所以在搅拌时,搅拌棒下端不能与三颈烧瓶底、温度计等接触,故B正确;
C.抽滤结束后,应注意先拆下连接抽气泵和吸滤瓶的橡皮管,然后关闭水龙头,以防倒吸,故C错误;
D.冷凝管中水的流向与蒸汽的流向相反,则冷凝管中水的流向是下进上出,故D正确;
故答案为:ABD;
(4)除去残留在苯甲酸中的甲苯应先加入,应该先加NaOH溶液,甲苯与NaOH不反应,苯甲酸与NaOH反应生成苯甲酸钠,分液,苯甲酸钠溶液中加盐酸可以制得苯甲酸,故答案为:NaOH溶液;浓盐酸酸化;
(5)设苯甲酸的物质的量浓度为x,则25mL苯甲酸溶液中苯甲酸的物质的量为0.025xmol,
C6H5COOH+KOH→C6H5COOK+H2O
1mol 1mol
0.025xmol 2.40×10-3mol
1mol:1mol=0.025xmol:2.40×10-3mol
x=$\frac{2.40×1{0}^{-3}mol×1mol}{1mol×0.025mol}$=0.96,
则100mL苯甲酸中苯甲酸的质量=0.096mol/L×0.1L×122g/mol=1.1712g,其质量分数=$\frac{1.1712g}{1.220g}$=96%,
故答案为:96%.
点评 本题考查了实验方案设计、混合物的分离和提纯,侧重考查分析问题能力、计算能力,明确物质的性质是解本题关键,知道根据物质的性质选取合适的分离方法.


 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案科目:高中化学 来源: 题型:选择题
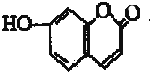
| A. | 该有机物分子式为C9H8O3 | |
| B. | 该有机物最多可以和4mol氢气发生反应 | |
| C. | 1 mo1该有机物与溴水反应,最多消耗2 mol Br2 | |
| D. | 1 mol该有机物最多与2 mol NaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食醋 | B. | 白酒 | C. | 食盐 | D. | 葡萄糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
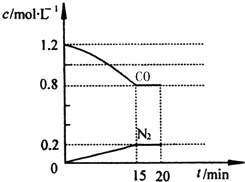
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 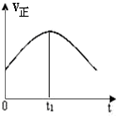 | B. | 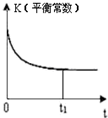 | C. | 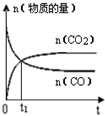 | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
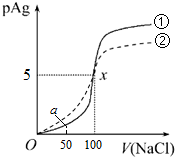
| A. | 原AgNO3溶液的物质的量浓度为1mol•L-1 | |
| B. | Kφ(AgCl)=1×10-10 | |
| C. | a点时,溶液中c(Cl-)=1.2×10-9mol•L-1 | |
| D. | 若把0.1mol•L-1的NaCl溶液换成0.1mol•L-1的NaI溶液,则pAg的变化图象变成曲线② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C50、N70、C120、C540等互称为同素异形体 | |
| B. | CH3CH2CH2CH2OH的名称是:丁醇 | |
| C. | 2-戊烯的结构简式:CH3CH2CH=CHCH3 | |
| D. | 质子数为94、中子数为144的钚(Pu)原子:${\;}_{92}^{144}$Pu. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色透明的溶液中:Cl-,Br-,Na+,Cu2+ | |
| B. | 含有大量ClO-的溶液中:SO42-,Cu2+,I-,Fe2+ | |
| C. | 使pH试纸变蓝的溶液中:CO32-,Cl-,F-,K+ | |
| D. | 水电离出c(H+)=1×10-12的溶液中:Ca2+,HCO3-,Mg2+,NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com