


科目:高中化学 来源: 题型:
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
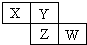 X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法不正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法不正确的是( )| A、氢化物的稳定性:X>Y |
| B、W的最高价氧化物对应水化物的酸性比Z的强 |
| C、Y的非金属性比X的强 |
| D、Y与Z形成的化合物是形成酸雨的主要物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在Na2S溶液中加入AgCl固体,溶液中c(S2-)不变 |
| B、Na2CO3溶液加水稀释后再恢复至原温度,pH和KW均减小 |
| C、室温下pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,水电离出的c(H+)之比104:1 |
| D、25°C,若测知氨水与NH4Cl混合溶液的pH>7,则溶液中c(NH4+)>c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、增大 | B、可能增大也可能减小 |
| C、减小 | D、不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com