
【题目】某同学在实验室进行铁盐与亚铁盐相互转化实验。
实验I:将Fe3+转化为Fe2+
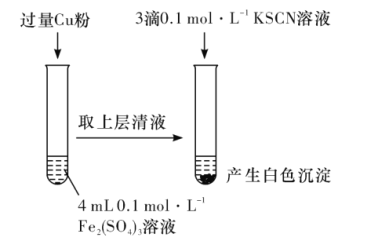
(1)Fe3+与Cu粉发生反应的离子方程式为__。
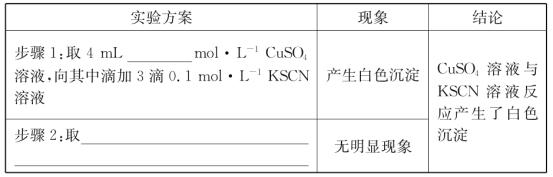
(2)探究白色沉淀产生的原因,请填写实验方案:__、__。
查阅资料:
已知:①SCN-的化学性质与I-相似。
②2Cu2++4I-=2CuI↓十I2。
则Cu2+与SCN-反应的离子方程式为__。
实验II:将Fe2+转化为Fe3+
探究上述现象出现的原因:
查阅资料:Fe2++NO![]() Fe(NO)2+(棕色)
Fe(NO)2+(棕色)
(3)用离子方程式解释NO产生的原因:__。
(4)从化学反应速率与限度的角度对体系中存在的反应进行
反应I:Fe2+与HNO3反应,
反应II:Fe2+与NO反应。
①依据实验现象,可推知反应I的速率比反应II__(填“快"或“慢”)。
②反应I是一个不可逆反应,设计实验方案加以证明___。
③请用化学平衡移动原理解释溶液由棕色变为黄色的原因:___。
【答案】2Fe3++Cu═2Fe2++Cu2+ 0.1mol/L 取4mL0.1mol/LFeSO4溶液,向其中滴加3滴0.1mol/LKSCN溶液 2Cu2++4SCN=2CuSCN↓+(SCN)2 3Fe2++4H++NO3═3Fe3++NO↑+2H2O 慢 取反应后的黄色溶液于试管中,向其中加入几滴K3Fe(CN)6溶液,无明显变化,说明反应Ⅰ是不可逆反应 导致Fe2+浓度降低,使平衡Fe2++NOFe(NO)2+逆向移动,最终Fe(NO)2+完全转化为Fe3+,溶液由棕色变为黄色
【解析】
(1)Fe3+与Cu粉发生反应生成铜离子与亚铁离子;
(2)图1中得到溶液中Fe2+为0.2mol/L,Cu2+为0.1mol/L,分别取相同浓度的硫酸铜溶液、硫酸亚铁溶液,滴入KSCN溶液进行对照实验;由题目信息ii可知,Cu2+与SCN-反应生成CuSCN沉淀,同时生成(SCN)2;
(3)亚铁离子具有还原性,酸性条件下硝酸根具有强氧化性,反应生成铁离子、NO与水;
(4)①反应速率快的反应现象最先表现;
②反应中硝酸过量,若存在平衡,溶液中含有Fe2+,否则没有Fe2+,可以用K3[Fe(CN)6]溶液检验;
③Fe2+被硝酸氧化为Fe3+,导致溶液中Fe2+浓度降低,导致平衡发生移动,最终Fe(NO)2+完全转化为Fe3+。
(1)Fe3+与Cu粉发生反应生成铜离子与亚铁离子,反应离子方程式:2Fe3++Cu═2Fe2++Cu2+;
(2)由反应2Fe3++Cu═2Fe2++Cu2+,可知图1中得到溶液中Fe2+为0.2mol/L,Cu2+为0.1mol/L,分别取相同浓度的硫酸铜溶液、硫酸亚铁溶液,滴入KSCN溶液进行对照实验,故实验方案为:步骤1:取4mL0.1mol/LCuSO4溶液,向其中滴加3滴0.1mol/LKSCN溶液,步骤2:取4mL0.1mol/LFeSO4溶液,向其中滴加3滴0.1mol/LKSCN溶液,由题目信息ii可知,Cu2+与SCN反应生成CuSCN沉淀,同时生成(SCN)2,反应离子方程式为:2Cu2++4SCN=2CuSCN↓+(SCN)2;
(3)铁离子具有还原性,酸性条件下硝酸根具有强氧化性,反应生成铁离子、NO与水,反应离子方程为:3Fe2++4H++NO3═3Fe3++NO↑+2H2O;
(4)①溶液先变为棕色,放置一段时间后,棕色消失,溶液变为黄色,反应速率快的反应现象最先表现,反应Ⅰ的速率比反应Ⅱ的慢;
②反应中硝酸过量,若存在平衡,溶液中含有Fe2+,否则没有Fe2+,具体的实验方案是:取反应后的黄色溶液于试管中,向其中加入几滴K3[Fe(CN)6]溶液,溶液无明显变化,说明反应I是不可逆反应;
③Fe2+被硝酸氧化为Fe3+,导致溶液中Fe2+浓度降低,导致平衡Fe2++NOFe(NO)2+逆向移动,最终Fe(NO)2+完全转化为Fe3+,溶液由棕色变为黄色。


科目:高中化学 来源: 题型:
【题目】反应A(g)+3B(g) ![]() 2C(g)+2D(g)在四种不同情况下的反应速率分别为
2C(g)+2D(g)在四种不同情况下的反应速率分别为
①v(A)=0.45 mol·L-1·min-1 ②v(B)=0.6 mol·L-1·s-1 ③v(C)=0.4 mol·L-1·s-1 ④v(D)=0.45 mol·L-1·s-1,该反应进行的快慢顺序为
A. ④>③=②>① B. ④<③=②<① C. ①>②>③>④ D. ④>③>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.用水稀释0.1mol·L-1的氨水,则溶液中![]() 增大
增大
B.化学反应的反应热只与反应途径有关,而与反应体系的始态和终态无关
C.在等体积等pH的盐酸和醋酸两溶液中分别加入等质量的相同锌粒,若只有一种溶液中的锌粒有剩余,则该溶液一定是盐酸
D.两种氨水的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c2=10c1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定石灰石样品中碳酸钙的质量分数,某学习小组进行了如下实验探究,取10g石灰石样品放入烧杯中,加入稀盐酸至不再产生气泡为止(石灰石中的杂质不溶于水,也不反应),并绘制了加入稀盐酸的质量与放出气体质量的坐标图(见图)。

(1)碳酸钙完全反应用去稀盐酸的质量为__________g。
(2)该石灰石样品中碳酸钙的质量分数为_________。
(3)当盐酸和石灰石恰好完全反应,所得溶液中溶质质量分数是_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定某石灰石中CaCO3的质量分数,称取W g石灰石样品,加入过量的浓度为6 mol/L的盐酸,使它完全溶解,加热煮沸,除去溶解的CO2,再加入足量的草酸铵[(NH4)2C2O4]溶液后,慢慢加入氨水降低溶液的酸度,则析出草酸钙沉淀,离子方程式为:C2O42-+Ca2+=CaC2O4↓,过滤出CaC2O4后,用稀硫酸溶解:CaC2O4+H2SO4=H2C2O4+CaSO4,再用蒸馏水稀释溶液至V0mL。取出V1mL用a mol/L的KMnO4酸性溶液滴定,此时发生反应:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,若滴定终点时消耗a mol/L的KMnO4V2mL,样品中CaCO3的质量分数为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】精细化工在生产和生活中有广泛而重要的应用。
(1)精细化学品往往有特定的功能从而广泛地应用于日常生活中,下列洗涤方法原理各不相同,请比较
①沾有油脂的器皿可用汽油擦洗,其原理是________;
②也可用洗洁精和水洗涤,其原理是_______;
③还可以用纯碱或稀氢氧化钠溶液洗涤,其原理是___________。
④如果水溶液的硬度很大,用肥皂与合成洗涤剂哪个洗涤剂效果更好?为什么? ____。
(2)据报道,我国某地发生误食工业用猪油的中毒事件,原因是工业品包装中混入有机锡等,下列有关叙述正确的是__________。
A.猪油是天然高分子化合物
B.猪油是高级脂肪酸甘油酯
C.猪油发生皂化反应后,反应液能使蓝色石蕊试纸变红
D.猪油皂化反应完全后,反应混合物静置后分为两层
(3)阿司匹林是一种常用的药剂,其化学名称为乙酰水杨酸,其分子结构如图:
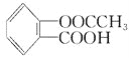
阿司匹林的一种同分异构体中含有苯环和两个羧基,且苯环上只有一个侧链,则阿司匹林的这种同分异构体的结构简式为____________。以苯酚为原料合成水杨酸,为阿司匹林的大量生产开辟了广阔的前景,其生产阿司匹林的流程如下:
![]()
![]()
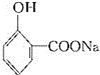
![]() 水杨酸
水杨酸![]() 阿司匹林
阿司匹林
写出反应②的化学方程式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第五主族的磷单质及其化合物在工业上有广泛应用.
(1)同磷灰石在高温下制备黄磷的热化学方程式为:
4Ca5(PO4)3F(s)+21SiO2(s)+30C(s)═3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g)△H
已知相同条件下:
4Ca3(PO4)2F(s)+3SiO2(s)═6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g)△H1
2Ca3(PO4)2(s)+10C(s)═P4(g)+6CaO(s)+10CO(g)△H2
SiO2(s)+CaO(s)═CaSiO3(s)△H3
用△H1、△H2和△H3表示△H,则△H=______;
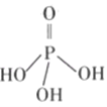
(2)三聚磷酸可视为三个磷酸分子(磷酸结构式如图)之间脱去两个水分子产物,其结构式为______,三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为______;
(3)次磷酸钠(NaH2PO2)可用于工业上的化学镀镍.
①化学镀镍的溶液中含有Ni2+和H2PO2﹣,在酸性等条件下发生下述反应:
(a) Ni2++ H2PO2﹣+ → Ni++ H2PO3﹣+
(b)6H2PO﹣2+2H+═2P+4H2PO3+3H2↑
请在答题卡上写出并配平反应式(a) ___________________________;
②利用①中反应可在塑料镀件表面沉积镍﹣磷合金,从而达到化学镀镍的目的,这是一种常见的化学镀.请从以下方面比较化学镀与电镀.
方法上的不同点:______;
原理上的不同点:______;
化学镀的优点:______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解一定浓度的CuSO4溶液,通电一段时间后,向所得的溶液中加入0.1 mol Cu(OH)2后恰好恢复到电解前的浓度和pH。则下列说法正确的是( )
A.电解过程中阴极没有气体生成
B.电解过程中转移的电子的物质的量为0.4 mol
C.原CuSO4溶液的浓度为0.1 mol·L-1
D.电解过程中阳极收集到的气体体积为1.12 L(标况下)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一氧化二氯(Cl2O)是一种常用的氯化剂。常温下,Cl2O是棕黄色、有刺激性气味的气体,熔点为-120.6℃,沸点为2.0℃,易与水反应生成次氯酸。实验室欲用氯气通入含水8%的碳酸钠固体中制备并收集少量纯净的Cl2O,请用下列装置设计实验并探究相关物质的性质。
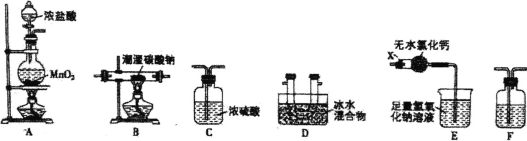
(1)装置E中仪器X的名称为_________。
(2)装置的连接顺序是A_______(每个装置限用一次)。
(3)装置F中盛装试剂的名称为_____,装置E中无水氯化钙的作用是_____。
(4)装置B残留固体中除NaCl外还含有一种酸式盐M,写出装置B中发生反应的化学方程式_____________。
(5)测定残留固体中M的质量分数:取m g样品加适量蒸馏水使之溶解,加入几滴酚酞,用0.1 mol/L的盐酸标准溶液滴定至溶液由红色变为无色,消耗盐酸V1 mL;再向已变无色的溶液中加入几滴甲基橙,继续用该盐酸滴定至溶液由黄色变橙色,又消耗盐酸V2 mL。
①实验时用到的玻璃仪器有烧杯、胶头滴管、玻璃棒、锥形瓶、___。
②求残留固体中M的质量分数___(用含m、V1和V2的代数式表示)。
③若用甲基橙作指示剂滴定结束时,滴定管尖头有气泡,测定结果将填_____(“偏高"、“偏低”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com