
| A. | 不锈钢、黄铜 | B. | 24K金、铜导线 | C. | 生铁、钢 | D. | 钱币、铜钟 |
科目:高中化学 来源: 题型:解答题
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
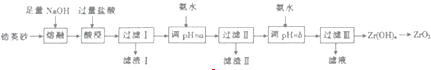
| 离子 | Fe3+ | AP+ | ZrO2+ |
| 开始沉淀pH | 1.9 | 3.3 | 6.2 |
| 完仝沉淀pH | 3.2 | 5.2 | 8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

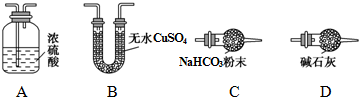
| 乙装置的质量(g) | 丙装置的质量(g) | |
| 加热前 | 80.00 | 62.00 |
| 加热后 | 80.36 | 62.88 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3溶液中通过量氨气:Al3++4OH-═AlO2-+2H2O | |
| B. | 过量铁与稀硝酸反应:Fe+4H++NO3-═Fe3++NO↑+3H2O | |
| C. | 氢氧化钠溶液中通过量二氧化硫:SO2+2OH-═SO32-+H2O | |
| D. | 溴化亚铁溶液与足量氯水反应:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 元素 | 结构或性质 |
| A | 原子最外层电子数是内层电子总数的$\frac{1}{5}$ |
| B | 形成化合物种类最多的元素,其单质为固体 |
| C | 生活中常见的金属,它有两种常见的氯化物,且相对分子质量相差35.5 |
| D | 地壳中含量最多的元素 |
| E | 与D同主族 |
| F | 与E同周期,且最外层电子数等于电子层数 |
 .
.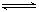 Al(OH)3
Al(OH)3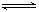 H++AlO2-+H2O;F的单质与C、D形成的相对分子质量为160的化合物在一定条件下反应的化学方程式是2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3.
H++AlO2-+H2O;F的单质与C、D形成的相对分子质量为160的化合物在一定条件下反应的化学方程式是2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烷和乙酸 | B. | 淀粉和纤维素 | ||
| C. | CH3CH2CH2CH3和CH3CH2CH3 | D. | 乙醇和二甲醚 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .其反应类型为消去反应.检验生成的乙烯要将气体先后通入氢氧化钠溶液、酸性高锰酸钾溶液或溴水中.(填试剂名称)
.其反应类型为消去反应.检验生成的乙烯要将气体先后通入氢氧化钠溶液、酸性高锰酸钾溶液或溴水中.(填试剂名称)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O很稳定,是因为水分子之间存在氢键 | |
| B. | 由于F非金属性最强,HF的氢键键能最大,所以HF的熔、沸点最高 | |
| C. | 卤素单质从上到下熔沸点升高,是因为它们的组成结构相似,从上到下其摩尔质量增大,分子间的范德华力增大 | |
| D. | 氨气极易溶于水,与氢键没有关系 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com