
已知W、X、Y、Z为短周期元素,W、Z同主族,X、Y、Z同周期,W的气态氢化物的稳定性大于Z的气态氢化物的稳定性,X、Y为金属元素,X的阳离子的氧化性小于Y的阳离子的氧化性。下列说法正确的是( )
A.X、Y、Z、W的原子半径依次减小
B.W与X形成的化合物中只含离子键
C.W的气态氢化物的沸点一定高于Z的气态氢化物的沸点
D.若W与Y的原子序数相差5,则二者形成化合物的化学式一定为Y2W3
 计算高手系列答案
计算高手系列答案科目:高中化学 来源:2014年高考化学考前题型专练 保温训练(一)(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值。下列叙述中正确的是 ( )。
A.7.8 g Na2O2中含有的阴离子数为0.2NA
B.铜与浓硫酸反应中,当转移的电子数为0.2NA时,生成的SO2为2.24 L
C.1 mol·L-1的NH4Cl溶液中的NH4+的数目小于NA
D.由NO2、O2组成的混合物中共有NA个分子,其中的氧原子数目为2NA
查看答案和解析>>
科目:高中化学 来源:2014年高考化学指导冲关 第6练水溶液中的离子平衡练习卷(解析版) 题型:选择题
已知常温下CH3COOH的电离平衡常数为Ka。常温下,向20 mL 0.1 mol·L-1 CH3COOH溶液中逐滴加入0.1 mol·L-1 NaOH溶液,其pH变化曲线如图所示(忽视温度变化)。下列说法中错误的是( )
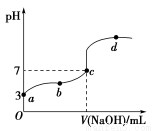
A.a点表示的溶液中由水电离出的H+浓度为1.0×10-11 mol·L-1
B.b点表示的溶液中c(CH3COO-)>c(Na+)
C.c点表示CH3COOH和NaOH恰好反应完全
D.b、d点表示的溶液中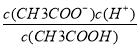 相等
相等
查看答案和解析>>
科目:高中化学 来源:2014年高考化学指导冲关 第5练化学反应速率和化学平衡练习卷(解析版) 题型:选择题
在一密闭容器中发生反应:2X(g)+Y(g) aZ(g) ΔH=Q kJ·mol-1,开始按体积比2∶1将X、Y充入反应器中,一定条件下发生反应。图甲和图乙是根据反应绘制的图象,下列有关说法正确的是( )
aZ(g) ΔH=Q kJ·mol-1,开始按体积比2∶1将X、Y充入反应器中,一定条件下发生反应。图甲和图乙是根据反应绘制的图象,下列有关说法正确的是( )
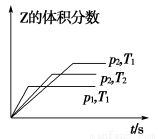
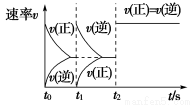
甲 乙
A.图甲,p1>p2,a<3
B.图甲,T1<T2,Q>0
C.图乙,t1时表示恒温、恒压条件下,向平衡体系中充入一定量的Z气体
D.图乙,如果a=3,t2时表示向体系中加入了催化剂或增大压强
查看答案和解析>>
科目:高中化学 来源:2014年高考化学指导冲关 第4练物质结构与元素周期律练习卷(解析版) 题型:选择题
短周期元素X、Y、Z、W的原子序数依次增大,X是形成化合物最多的元素且X常见化合价为+1和-1,Y原子最外层电子数是次外层的3倍;Z与X处于同一主族,W的原子序数是Y的2倍。下列叙述不正确的是( )
A.原子半径的大小顺序:rZ>rW>rY>rX
B.元素Y的简单气态氢化物的热稳定性比W的弱
C.化合物Z2Y2与X2Y反应时,Z2Y2既是氧化剂又是还原剂
D.由X、Y、Z、W四种元素组成的化合物其水溶液一定显酸性
查看答案和解析>>
科目:高中化学 来源:2014年高考化学指导冲关 第3练化学反应与能量变化练习卷(解析版) 题型:填空题
铝是地壳中含量最高的金属元素,其单质及合金在生产生活中的应用日趋广泛。
真空碳热还原-氯化法可实现由铝土矿制备金属铝,其相关反应的热化学方程式如下:
Al2O3(s)+AlCl3(g)+3C(s)=3AlCl(g)+3CO(g)
ΔH=a kJ·mol-1
3AlCl(g)=2Al(l)+AlCl3(g)ΔH=b kJ·mol-1
(1)反应Al2O3(s)+3C(s)=2Al(l)+3CO(g)的ΔH=________kJ·mol-1(用含a、b的代数式表示)。
(2)Al4C3是反应过程中的中间产物。Al4C3与盐酸反应(产物之一是含氢量最高的烃)的化学方程式为______________________________________。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学指导冲关 第3练化学反应与能量变化练习卷(解析版) 题型:选择题
下列说法正确的是( )
A.任何酸与碱发生中和反应生成1 mol H2O的过程中,能量变化均相同
B.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同
C.已知:①2H2(g)+O2(g)=2H2O(g) ΔH=-a kJ·mol-1,
②2H2(g)+O2(g)=2H2O(l) ΔH=-b kJ·mol-1,则a>b
D.已知:①C(s,石墨)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1,
②C(s,金刚石)+O2(g)=CO2(g) ΔH=-395.0 kJ·mol-1,
则C(s,石墨)=C(s,金刚石) ΔH=+1.5 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2014年高考化学指导冲关 第2练氧化还原反应和离子反应练习卷(解析版) 题型:选择题
下列说法正确的是( )
A.常温常压下,22.4 L氯气与足量镁粉充分反应,转移的电子数为2NA
B.化合反应均为氧化还原反应
C.电解NaCl溶液得到22.4 L H2(标准状况),理论上需要转移NA个电子(NA表示阿伏加德罗常数)
D.易燃试剂与强氧化性试剂分开放置并远离火源
查看答案和解析>>
科目:高中化学 来源:2014年高考化学指导冲关 第13练物质结构与性质练习卷(解析版) 题型:填空题
碳、氢、氟、氮、硅等非金属元素与人类的生产生活息息相关。回答下列问题。
(1)写出硅原子的电子排布式________。C、Si、N的电负性由大到小的顺序是________。
(2)氟化氢水溶液中存在的氢键有________种。
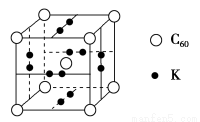
(3)科学家把C60和K掺杂在一起制造了一种富勒烯与钾的化合物,该物质在低温时是一种超导体,其晶胞如图所示,该物质中K原子和C60分子的个数比为________。
(4)继C60后,科学家又合成了Si60、N60。请解释如下现象:熔点Si60>N60>C60,而破坏分子所需要的能量N60>C60>Si60,其原因是________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com