
【题目】下列实验操作正确的是( )
A.用量筒量取 5mL 蒸馏水
B.用分液漏斗分离乙醇和水
C.用托盘天平称量 NaCl 固体 5.8g
D.用 pH 试纸测氯水的 pH
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.O2和O3互为同位素
B.金刚石、石墨、富勒烯互为同素异形体
C.有机物CH3-CH2-NO2和H2N-CH2-COOH互为同分异构体
D.C4H10的一氯代物有四种,其熔沸点各不相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴乙烷中含有少量乙醇杂质,下列方法中可以除去该杂质的是( )
A. 加入浓硫酸并加热到170℃,使乙醇变成乙烯而逸出
B. 加入氢溴酸并加热,使乙醇转化为溴乙烷
C. 加入金属钠,使乙醇发生反应而除去
D. 加水振荡,静置分层后,用分液漏斗分离去水层
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里需要纯净的NaCl溶液,但手边只有混有Na2SO4、NH4HCO3的NaCl。某学生设计了如图所示方案提取纯净的NaCl溶液。(已知:NH4HCO3![]() NH3↑+CO2↑+H2O)
NH3↑+CO2↑+H2O)
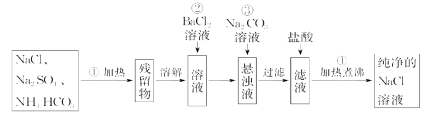
如果此方案正确,那么:
(1)进行操作①可选择的最常用仪器是______________。
(2)操作②为什么不用硝酸钡溶液,其理由是_____________________________。
(3)进行操作②后,如何判断![]() 已除尽,方法是_________________________。
已除尽,方法是_________________________。
(4)操作③的目的是________________,为什么不先过滤后加碳酸钠溶液?理由是____________。
(5)操作④的目的是________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置(电极均为惰性电极)可吸收SO2 , 并用阴极排出的溶液吸收NO2 . 下列说法正确的是( ) 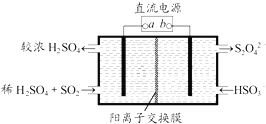
A.a为直流电源的负极
B.阴极的电极反应式为:2HSO3﹣+2H++e﹣═S2O42﹣+2H2O
C.阳极的电极反应式为:SO2+2H2O﹣2e﹣═SO42﹣+4H+
D.电解时,H+由阴极室通过阳离子交换膜到阳极室
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某澄清透明的酸性溶液中,能共存的离子组是( )
A.NH4+、Cl﹣、Fe2+、K+B.Na+、CO32﹣、K+、Cl﹣
C.Cl﹣、Ba2+、Na+、SO42﹣D.K+、SO42﹣、OH﹣、Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E都是周期表中前四周期的元素,且原子序数依次增大,其中A原子核外有三个未成对电子;A与B可形成离子化合物B3A2;C元素是地壳中含量最高的金属元素;D原子核外的M层中有两对成对电子;E原子核外最外层只有1个电子,其余各层电子均充满。请根据以上信息,回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示):
(1)比E核外电子数少5的元素的原子核外电子排布式是 ,A、B、C、D的第一电离能由小到大的顺序为 。
(2)B的氯化物的熔点远高于C的氯化物的熔点,理由是 。
(3)A的氢化物属于 (填“极性”或“非极性”)分子,D的低价氧化物分子的立体构型是 。
(4)A、E形成的某种化合物的晶胞结构如图所示,则其化学式为 (每个球均表示1个原子)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】脱去冶金工业排放烟气中SO2的方法有多种.
(1)利用本生(Bunsen)热化学循环吸收SO2工艺由下列三个反应组成: 2H2(g)+O2(g)═2H2O(I)△H1=﹣572kJmol﹣1
2HI(g)═H2(g)+I2(g)△H2=+10kJmol﹣1
2H2SO4(I)═2SO2(g)+2H2O(g)+O2(g)△H3=+462kJmol﹣1
则得SO2(g)+I2(g)+2H2O(I)═2HI (g)+H2SO4(I)△H=kJmol﹣1
(2)氧化锌吸收法.配制ZnO悬浊液,在吸收塔中封闭循环脱硫.测得pH、吸收效率η随时间t的变化如图1所示;溶液中部分微粒与PH的关系如图2所示. 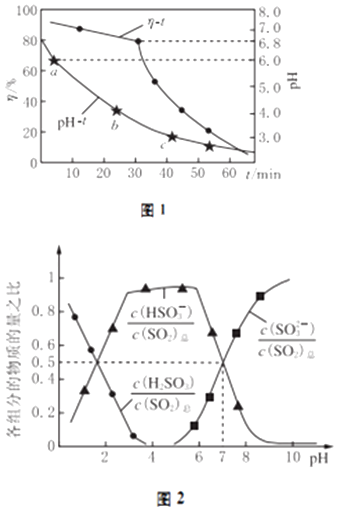
①为提高SO2的吸收效率η,可采取的措施有:增大悬浊液中ZnO的量、 .
②图1中的pH﹣t曲线ab段发生的主要化学方程式为
③pH=7时,溶液中 ![]() =
=
(3)如图3所示,利用惰性电解电解含SO2的烟气回收S及H2SO4 , 以实现废物利用. 
①阴极的电极反应式为 .
②每处理含19.2g SO2的烟气,理论上回收S、H2SO4的物质的量分别为、 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com