
【题目】化学与生活、社会发展息息相关,下列有关说法不正确的是
A. “霾尘积聚难见路人”,霾尘所形成的气溶胶有丁达尔效应
B. “熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应
C. “青蒿一握,以水二升渍,绞取汁”,此法对青蒿素的提取属于化学变化
D. 古剑“沈卢”“以剂钢为刃,柔铁为茎干”,剂钢指的是铁的合金
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】二氯化砜(SO2Cl2)是一种无色液体,主要用于有机物和无机物的氯化等。其熔点为-54.1℃.沸点为69.2℃;常温下比较稳定,受热易分解,遇水剧烈反应生成硫酸和盐酸。
(1)制备。实验室可利用SO2和Cl2按下列装置制取少量SO2Cl2(丙中放有樟脑液,起催化作用)。已知SO2(g)+Cl2(g)![]() SO2Cl2(g) △H<0
SO2Cl2(g) △H<0
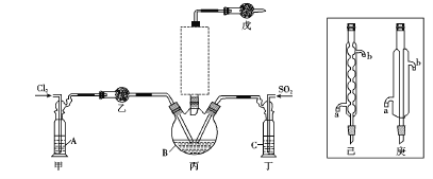
①可以用浓盐酸和酸性高锰酸钾制取氯气,该反应的化学方程式为 ;溶液A为 。
②上图实框中仪器己的名称为 ;反应装置图的虚框中未画出的仪器是 (填“己”或“庚”)。
③如果将丙装置放入冰水中,会更有利于二氯化砜的生成,其原因是 。
④下列有关说法错误的是 (填编号)。
a.乙、戊装置相同,在实验中的作用也完全相同
b.甲、丁装置为洗气装置,可用于气体的除杂和干燥
c.组装仪器后首先要进行的操作是检查装置的气密性
d.为提高反应物的利用率,可控制甲、丁装置中产生气泡的速率相等
(2)提纯。将收集到的产物进行减压蒸馏,减压蒸馏的目的是 。
(3)测定。取1.00g蒸馏后液体,小心地完全溶于水,向所得的溶液中加入足量氯化钡溶液,测得生成沉淀的质量为1.60g,则所得蒸馏成分中二氯化砜的质量百分含量为 %。
(4)贮存。二氯化砜应储存于阴凉、干燥、通风良好的库房。但久置后微显黄色,其原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以铬铁矿(含有Cr2O3,FeO、Al2O3、SiO2等成分)为主要原料生产重铬酸钠晶体(Na2Cr2O7·2H2O),其主要工艺流程如下:
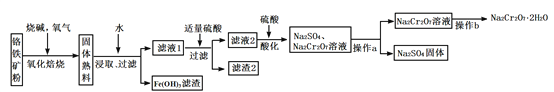
提示:熟料中含有Na2CrO4、NaFeO2等成分。
回答下列问题:
(1)将铬铁矿粉碎的目的是_____________________________ 。
(2)氧化焙烧时,生成Na2CrO4的化学方程式是__________。
(3)滤渣2中除Al(OH)3外还有__________(填化学式)。
(4)加入硫酸酸化的目的是__________________________。
(5)根据下图,请将操作a补充完整:________________,洗涤,干燥。
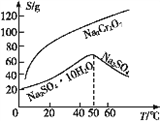
(6)控制105~110℃,向较浓的Na2Cr2O7溶液中加入KCl固体发生复分解反应,立即析出K2Cr2O7晶体。能生成K2Cr2O7晶体的原因是_____________。
(7)向Na2Cr2O7酸性溶液中加入过量FeSO4溶液,生成Cr3+和 Fe3+,再加入过量的强碱溶液生成铁铬氧体沉淀(CrxFe3-xO4)。加入过量强碱生成铁铬氧体沉淀的离子方程式是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物E(结构简式为 )是合成消毒剂α——萜品醇(结构简式为
)是合成消毒剂α——萜品醇(结构简式为 )的中间体。由甲苯经一系列变化制取E的流程如下:
)的中间体。由甲苯经一系列变化制取E的流程如下:

请回答下列问题:
(1)化合物E中含有的官能团名称为________,α—萜品醇的分子式为_________,甲苯的结构简式为_____。
(2)反应I的化学方程式为____________。
(3)反应II的反应类型是__________________。
(4)反应III的试剂与条件为__________________。
(5)写出一种符合下列条件的有机物的结构简式_____________。
①是化合物D的一种同分异构体;②能与NaHCO3反应;③能与新制氢氧化铜浊液在加热条件下反应生成红色固体;④在核磁共振氢谱上有5个峰。
(6)下面是由化合物E合成一种α—萜品醇的流程的一部分,请将其中有G生成H的几步流程补充完整(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件).________________。

提示:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中不宜用物理性质区别的是( )
A. Na2CO3 和 CaCO3 固体 B. 酒精和汽油
C. 氯化铵和硝酸铵晶体 D. 碘和高锰酸钾固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明末宋应星的著书《天工开物》中记载了我国古代炼锌的方法,用炉甘石(主要成分是ZnCO3)和木炭混合加热分两步反应得到锌,写出其中氧化还原反应的化学方程式_____________。
现代工业上利用锌焙砂提炼金属锌的流程如下图所示(已知:①锌焙砂的主要成分是ZnO、ZnFe2O4,还含有少量FeO、CuO、NiO杂质;②金属活动性顺序:Zn>Ni>Cu),请回答下列问题:

(2)化合物ZnFe2O4中Fe的化合价为_________,酸浸时,ZnFe2O4发生反应的化学方程式为________。
(3)净化I操作分两步:首先用H2O2处理酸浸液,然后用物质A调节溶液的PH使Fe3+转化为Fe(OH)3沉淀过滤后除去。
①写出用H2O2处理酸浸液时发生反应的离子方程式______________。
②下图中的斜线是溶液中金属阳离子浓度(纵标)随pH值(横标)变化时的沉淀溶解平衡线,若加入物质A只使Fe3+沉淀完全,则物质A可能是_____________(填出一种可能的化学式),调节后溶液的pH应控制在______________范围内(假设杂质离子浓度均不大于0.1mol· L-1 )。
③此流程中没有用调节pH来除去Cu2+的原因是_____________。

(4)净化II欲分离出Cu、Ni,加入的B物质的化学式_____________。
(5)本流程中可以循环利用的化合物有_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子液体在有机合成、无机合成等方面有着重要应用。咪唑是合成“离子液体”的一种原料,其结构如图所示。下列有关咪唑说法不正确的是
![]()
A. 化学式C3H4N2
B. 分子中含有一种非极性键和两种极性键
C. 可以发生取代、加成、氧化反应
D. 一氯取代物的同分异构体共有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“3G”手机出现后,以光导纤维为基础的高速信息通道尤显重要。下列物质中用于制造光导纤维的材料是
A.铜合金 B.陶瓷 C.聚乙烯 D.二氧化硅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝氢化钠(NaAlH4)是有机合成的重要还原剂。某课题组经查阅资料后设计合成铝氢化钠的简易流程如图所示。

已知:①AlCl3、NaH、NaAlH4遇水都能迅速发生反应。
②常温下,可用高锰酸钾、氯酸钾、重铬酸钾、次氯酸钙等与浓盐酸反应制取氯气。
(1)铝氢化钠遇水发生剧烈反应,甚至可能发生爆炸,其原因是_______________。写出铝氢化钠与水反应的化学方程式_____________________。
(2)甲同学设计实验制备无水氯化铝的装置如图所示。
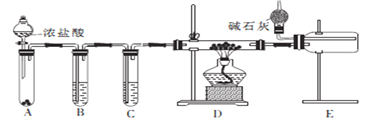
①装置E中干燥管的作用是_______________________。
②点燃装置D处酒精灯之前 需先排尽装置内的空气,其操作方法是________________。
(3)乙同学分析甲同学设计的装置后,认为只改变A、B、D中的试剂就可以用甲同学设计的装置制备NaH。
①试管B中的试剂改为____________________。
②若操作不当,则制得的NaH产品中可能含有的杂质有_________________。
(4)丙同学设计以下4种装置测定铝氢化钠样品的纯度(假设杂质不参与反应)。
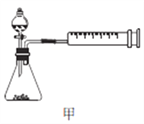
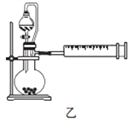
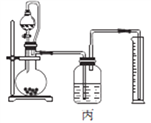
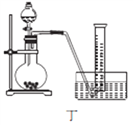
从易操作性、准确性角度考虑,宜选装置________。铝氢化钠与水完全反应,冷却至室温的标志是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com