
【题目】化合物H是一种有机光电材料中间体。实验室由芳香化合物A制备H的一种合成路线如下:
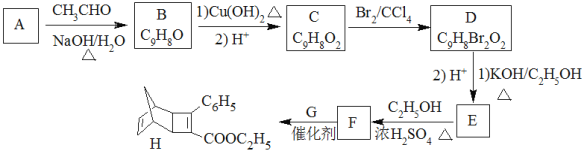
已知:
![]()
![]()
回答下列问题:
(1)A的化学名称为_____________________。
(2)由C生成D和E生成F的反应类型分别为__________、_________。
(3)E的结构简式为________________________。
(4)G为甲苯的同分异构体,由F生成H的化学方程式为________________________。
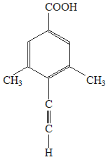
(5)芳香化合物X是F的同分异构体,X能与饱和碳酸氢钠溶液反应放出CO2,其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6∶2∶1∶1,写出1种符合要求的X的结构简式_____________________________。
(6)写出用环戊烷和2-丁炔为原料制备化合物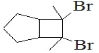 的合成路线_______(其他试剂任选)。
的合成路线_______(其他试剂任选)。
【答案】苯甲醛加成反应取代反应(或酯化反应)
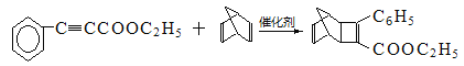
 、
、 、
、 、
、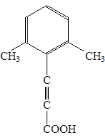 (任写1种)
(任写1种)
【解析】
A![]() B 发生题给信息
B 发生题给信息![]() 反应,B中含有9个碳原子,则A中含有7个碳原子且有一个-CHO,因此A为苯甲醛,B为
反应,B中含有9个碳原子,则A中含有7个碳原子且有一个-CHO,因此A为苯甲醛,B为 ,C为
,C为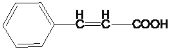 ,D为
,D为 。由F与G发生题给的成环反应,E中有碳碳三键,E为
。由F与G发生题给的成环反应,E中有碳碳三键,E为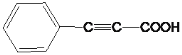 ,E与乙醇发生酯化反应,因此F为
,E与乙醇发生酯化反应,因此F为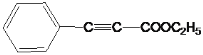 , G为
, G为 。
。
(1)根据上述分析可知,A为苯甲醛;
(2)C为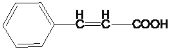 ,分子中含有碳碳双键,可以与溴单质发生加成反应;E为
,分子中含有碳碳双键,可以与溴单质发生加成反应;E为 ,分子中含有羧基,与乙醇可以发生酯化反应(取代反应);
,分子中含有羧基,与乙醇可以发生酯化反应(取代反应);
(3)F与G发生题给的成环反应,E中有碳碳三键,E为 ;
;
(4)G为甲苯的同分异构体,且F与G发生题干给信息二,因此反应方程式为: ;
;
(5)X中含有苯环,X能与饱和碳酸氢钠溶液反应放出CO2,说明X含有-COOH,其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6∶2∶1∶1,说明不同化学环境的氢个数之比为6∶2∶1∶1,因此X可能为; 、
、 、
、 、
、 (任写1种);
(任写1种);
(6)要将两种物质组合在一起,由题给信息可知, 一种含有碳碳三键(2-丁炔),另一种含有碳碳双键。环戊烷先与氯气取代生成一氯环戊烷,再在氢氧化钠醇溶液、加热条件下消去,生成环戊烯,再与2-丁炔反应,最后与溴加成。具体流程如下 。
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】在一定温度下的定容容器中,当下列哪些物理量不再发生变化时,表明反应:
A(s)+2B(g)![]() C(g)+D(g)已达到平衡状态的是( )
C(g)+D(g)已达到平衡状态的是( )
① 混合气体的压强;② 混合气体的密度;③ B的物质的量浓度;④ 气体总物质的量;⑤ 混合气体的平均相对分子质量;⑥ C、D反应速率的比值
A. ②③⑤ B. ①②③ C. ②③④⑥ D. ①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)有机物命名:
![]() ________________________________;
________________________________;
![]() ___________________________________;
___________________________________;
(2)依据名称写出物质:
3,4-二甲基-4-乙基庚烷 ______________;3,4,4-三甲基-1-戊炔 ______________。
(3)已知有机物降冰片二烯的分子结构可表示为:
①降冰片二烯的分子式为 ______________;②降冰片二烯属于 __________;
a.环烃 b.不饱和烃 c.烷烃 d.烯烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】液流电池是一种新型可充电的高性能蓄电池,其工作原理如下图。两边电解液存储罐盛放的电解液分别是含有V3+、V2+的混合液和VO2+、VO2+酸性混合液,且两极电解液分开,各自循环。下列说法不正确的是( )

A.充电时阴极的电极反应是V3++e-=V2+
B.放电时,VO2+作氧化剂,在正极被还原,V2+做还原剂,在负极被氧化
C.若离子交换膜为质子交换膜,充电时当有1mol e-发生转移时,左槽电解液的H+的物质的量增加了1mol
D.若离子交换膜为阴离子交换膜,放电时阴离子由左罐移向右罐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常见无机物A、B、C、D存在如图转化关系:
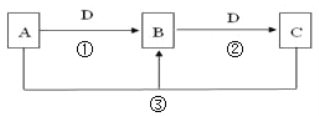
(1)若D是氯碱工业的主要产品,B有两性氢氧化物,则反应②的离子方程式是:______。
(2)若A是一种碱性气体,常用作制冷剂,B是汽车尾气之一,遇空气会变色,则反应①的化学方程式为__________________________________。
(3)若A为常见挥发性强酸,D是生产生活中用量最大用途最广的金属单质,,则B的化学式可能是________。
(4)若A、C、D都是常见气体,C是形成酸雨的主要气体,则反应③的化学方程式_______。
(5)若A、B、C的水溶液均显碱性,焰色反应均为黄色,D为CO2,用离子方程式解释B溶液显碱性的原因(用离子方程式表示)__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是几种弱电解质的电离平衡常数、难溶电解质的溶度积Ksp(25℃)。
电解质 | 电离方程式 | 电离常数K或Ksp |
CH3COOH | CH3COO | 1.76×10-5 |
H2CO3 | H2CO3 HCO3- | K1=4.31×10-7 K2=5.61×10-11 |
C6H5OH | C6H5OH | 1.1×10-10 |
H3PO4 | H3PO4 H2PO4- HPO42- | K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 |
NH3·H2O | NH3·H2O | 1.76×10-5 |
BaSO4 | BaSO4(s) | 1.07×10-10 |
BaCO3 | BaCO3(s) | 2.58×10-9 |
回答下列问题:
(1)由上表分析,若①CH3COOH,②HCO3-,③C6H5OH,④H2PO4-均可看做酸,则它们酸性由强到弱的顺序为_____________(填编号)。
(2)写出C6H5OH与Na3PO4反应的离子方程式_______________________________。
(3)25℃时,将等体积等浓度的醋酸和氨水混合,混合液中:c(CH3COO-)____c(NH4+)(填“>”、“=”或“<”)。
(4)25℃时,向10mL0.01mol/L苯酚溶液中滴加VmL0.01mol/L氨水,混合液中粒子浓度关系正确的是__________(填字母序号)。
A.若混合液pH>7,则V≥10
B.若混合液 pH<7,则c(NH4+)>c(C6H5O-)>c(H+)>c(OH-)
C.V=10时,混合液中水的电离程度小于10mL0.01mol/L苯酚溶液中水的电离程度
D.V= 5时,2c(NH3·H2O)+2c(NH4+)=c(C6H5O-)+c(C6H5OH)
(5)水解反应是典型的可逆反应,水解反应的化学平衡常数称为水解常数(用Kb表示),类比化学平衡常数的定义,请写出Na2CO3第一步水解反应的水解常数的表达式:____________。
(6)I,如图所示,有T1、T2两种温度下两条BaSO4在水中的沉淀溶解平衡曲线,回答下列问题:

①T1______T2(填“>”、“=”或‘‘<”),T2温度时 Ksp(BaSO4)=_______________;
②讨论T1温度时BaSO4的沉淀溶解平衡曲线,下列说法正确的是______(填字母序号)。
A.加入Na2SO4可使溶液由a点变为b点
B.在T1曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
C.蒸发溶剂可能使溶液由d点变为曲线上a,b之间的某一点(不含a,b)
D.升温可使溶液由b点变为d点
II.现有0.2mol的BaSO4沉淀,每次用1L饱和Na2CO3溶液(浓度为1.7mol/L)处理。若使BaSO4中的SO42-全部转化到溶液中,需要反复处理_____次。[提示:BaSO4(s)+CO32-(aq)![]() BaCO3(s)+SO42-(aq)]
BaCO3(s)+SO42-(aq)]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、将 5 g 钠铝合金投入到 200 mL 的水中,固体完全溶解,产生 4.48 L 标准状况下的气体,溶液中只有一种溶质。经过分析得出钠铝合金中两种金属的物质的量之比为_______,所得溶液中溶质的物质的量浓度为__________(假设溶液体积变化忽略不计)。
Ⅱ、把由 NaOH、AlCl3、MgCl2 三种固体组成的混合物溶于足量水中,有 0.58 g 白色难溶物析出,向所 得溶液中逐滴加人 0.5 mol L-1 的盐酸,加入盐酸的体积和生成沉淀的质量如下图所示:

请计算:
(1)混合物中 MgCl2 的质量__________g;
(2)P 点表示盐酸加入的体积_________ml。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铜晶体(CuSO4·xH2O)是一种用途广泛的试剂。某小组拟探究硫酸铜性质并测定其晶体中结晶水含量。
实验(一):探究硫酸铜的氧化性。
取适量硫酸铜溶液于试管,加入(NH4)2SO3溶液,产生沉淀M。过滤、洗涤、得M固体。为了探究M的组成,进行如下实验:
①取一定量M固体分成两份;
②在一份固体中加入稀硫酸,产生刺激性气味的气体X,将气体X通入溴水中,溴水褪色;溶液变成蓝色并有红色固体生成。
③在另一份固体中加入浓烧碱溶液,共热,产生的气体Y通入甲基橙溶液中,溶液变黄色。
(1)X的化学式是______________。
(2)经测定,M中阳离子、阴离子个数之比为2∶1。写出M与稀硫酸反应的化学方程式:____________。
实验(二):探究硫酸铜晶体的热稳定性。
他们取少量硫酸铜晶体进行实验,装置如图所示。
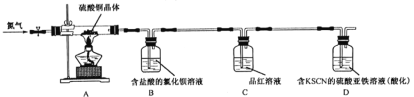
观察到的实验现象:A中蓝色晶体逐渐变成白色粉末,最后变成黑色粉末;B中产生白色沉淀;D中无色溶液变红色溶液。
(3)B中用盐酸酸化的目的是______________;C中现象是__________________________________。
(4)D中有单质参加反应的离子方程式:________________________________________________。
实验(三):测定硫酸铜晶体中结晶水含量。
取wg硫酸铜晶体(CuSO4·xH2O)配制成250mL溶液,取20.00mL所配制溶液用cmol·L-1EDTA(简化为Na4Y)溶液滴定至终点,消耗EDTA滴定液休积为VmL。(滴定反应:Cu2++Y4-=CuY2-)
(5)x=_____________________(用代数式表示)。
(6)下列情况会使测得x值偏大的是______________(填字母)。
a.样品失去部分结晶水 b.滴定管未用EDTA溶液润洗
c.开始读数时滴定管尖嘴有气泡(终点时尖嘴无气泡) d.滴定终点时俯视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 已知:H2(g)+![]() O2(g)═H2O(l);△H=﹣285.8 kJmol﹣1 , 则H2的燃烧热为﹣285.8 kJmol﹣1
O2(g)═H2O(l);△H=﹣285.8 kJmol﹣1 , 则H2的燃烧热为﹣285.8 kJmol﹣1
B. 已知:S(g)+O2(g)═SO2(g)△H1=﹣Q1;S(s)+O2(g)═SO2(g)△H2=﹣Q2 , 则Q1<Q2
C. 已知:![]() H2SO4(浓)+NaOH(aq)═
H2SO4(浓)+NaOH(aq)═![]() Na2SO4(aq)+H2O(l)△H1;CH3COOH(aq)+NH3H2O(aq)═CH3COONH4(aq)+H2O(l)△H2 , 则有|△H1|<|△H2|
Na2SO4(aq)+H2O(l)△H1;CH3COOH(aq)+NH3H2O(aq)═CH3COONH4(aq)+H2O(l)△H2 , 则有|△H1|<|△H2|
D. 已知:Fe2O3(s)+3C(石墨)═2Fe(s)+3CO(g)△H=+489.0 kJmol﹣1
CO(g)+![]() O2(g)═CO2(g)△H=﹣283.0 kJmol﹣1
O2(g)═CO2(g)△H=﹣283.0 kJmol﹣1
C(石墨)+O2(g)═CO2(g)△H=﹣393.5 kJmol﹣1
则4Fe(s)+3O2(g)═2Fe2O3(s)△H=﹣1641.0 kJmol﹣1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com