
 化石燃料开采、加工过程常产生H2S废气,H2S的转化是资源利用和环境保护的重要课题.
化石燃料开采、加工过程常产生H2S废气,H2S的转化是资源利用和环境保护的重要课题.分析 (1)H2S中含有S-H键,与水的结构相似;
(2)H2S是二元弱酸,可电离出HS-离子,与少量氨气反应可生成NH4HS;
(3)根据图中各元素化合价变化分析,该反应中S元素化合价由-2价变为0价、O元素化合价由0价变为-2价,根据氧化还原反应中得失电子相等;
(4)根据题意知,该反应是可逆反应,反应物是硫化氢,根据图象知,生成物中含有S元素的物质是氢气的一半,则生成物是S2和H2,再结合反应条件书写方程式.
解答 解:(1)H2S中含有S-H键,与水的结构相似,结构式为H-S-H,故答案为:H-S-H;
(2)H2S是二元弱酸,可电离出HS-离子,电离方程式为H2S?HS-+H+,与少量氨气反应可生成NH4HS,反应的化学方程式为H2S+NH3=NH4HS,
故答案为:H2S?HS-+H+;H2S+NH3=NH4HS;
(3)①根据图中各元素化合价知,Cu元素化合价都是+2价、H元素化合价都是+1价、Cl元素化合价都是-1价,所以化合价不变的是Cu、H、Cl元素,
故答案为:Cu、H、Cl;
②H2S不稳定,易被氧气氧化生成S单质,反应方程式为2H2S+O2=2S+2H2O,该反应中S元素化合价由-2价变为0价、O元素化合价由0价变为-2价,根据氧化还原反应中得失电子相等得,反应中当有1mol H2S转化为硫单质时,保持溶液中Fe3+的物质的量不变,消耗O2的物质的量=$\frac{1mol}{2}$=0.5mol,
故答案为:0.5mol;
(4)根据题意知,该反应是可逆反应,反应物是硫化氢,根据图象知,生成物中含有S元素的物质是氢气的一半,则生成物是S2和H2,该反应方程式为2H2S?2H2+S2,故答案为:S2.
点评 本题以S为载体考查了氧化还原反应,图象分析判断等知识点,为高频考点,会正确分析图象中各个物理量的含义是解本题关键,再结合氧化还原反应中各个物理量之间的关系,化学方程式书写等有关知识来分析解答即可,题目难度中等.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:选择题
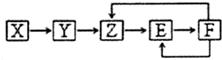 已知X、Y、Z、E、F五种常见物质含有同一元素M,在一定条件下它们有如图转化关系,Z是NO,下列推断不合理的是( )
已知X、Y、Z、E、F五种常见物质含有同一元素M,在一定条件下它们有如图转化关系,Z是NO,下列推断不合理的是( )| A. | X可能是一种氢化物 | B. | X生成Z一定是化合反应 | ||
| C. | E可能是一种有色气体 | D. | F中M元素的化合价可能为+5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 如果汽油、煤油等可燃物着火,应立即用水扑灭 | |
| B. | 在点燃易燃气体前,必须检验气体的纯度 | |
| C. | 为防止试管破裂,加热固体高锰酸钾制氧气时,试管口应略向下倾斜 | |
| D. | 萃取操作时,应选择可以和原溶剂不互溶的萃取剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不能发生丁达尔效应的分散系有氯化钠溶液、水等 | |
| B. | 在1 L 2 mol•L-1 Fe(OH)3胶体中,含有的Fe(OH)3胶体粒子数为2NA | |
| C. | 在Fe(OH)3胶体中滴入少量稀硫酸将有沉淀产生 | |
| D. | 淀粉胶体中含有少量的NaCl,可用适量AgNO3溶液除去 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤⑥ | B. | ②③④⑤ | C. | ①③④⑤⑦ | D. | ①④⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
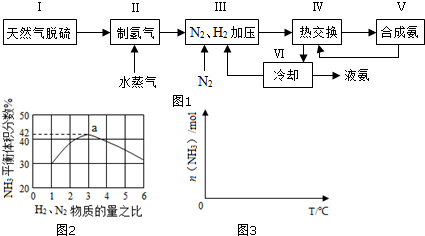
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在100 mL 1 mol•L-1的 Fe(NO3)3的溶液中通入足量SO2:2Fe3++SO2+2H2O═2Fe2++SO42-+4H+ | |
| B. | 在100 mL 2 mol•L-1的FeI2的溶液中通入标况下5.6 L的Cl2:4Fe2++6I-+5Cl2═4Fe3++3I2+10Cl- | |
| C. | 向NaHCO3溶液中加入过量的澄清石灰水:2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32- | |
| D. | 向明矾溶液中加入过量的氢氧化钡溶液:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
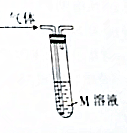 利用如图所示装置和对应试剂不能达到相应实验目的是( )
利用如图所示装置和对应试剂不能达到相应实验目的是( ) | 选项 | 实验目的 | M溶液 | 现象 |
| A | 检验乙烷中含有的乙烯 | 酸性高锰酸钾溶液 | 溶液颜色变浅 |
| B | 检验工业合成氨混合气体中的NH3 | 酚酞溶液 | 溶液变红 |
| C | 检验CO2中含有的SO2 | 品红溶液 | 溶液褪色 |
| D | 检验Cl2中含有的HCl | 硝酸银溶液 | 产生白色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com