
元素周期表中同周期或同主族元素,随着原子序数的递增,下列说法正确的是
A.ⅦA族元素的氢化物沸点逐渐升高
B.ⅥA族元素的原子核外最外层电子数逐渐增多
C.碱金属元素的最高价氧化物的水化物的碱性逐渐增强
D.第二周期元素(除稀有气体元素)的最高化合价数值逐渐增大
科目:高中化学 来源: 题型:
Fe、C、N、O、H可以组成多种物质。回答以下问题:
(1)基态铁原子中,未成对电子数有 个。
(2)铁单质在一定条件下可与CO反应生成配位化合物——羰基
铁[Fe(CO)5],其结构如右图。已知CO分子与N2分子结构相
似,分子中C、O原子均能提供孤电子对形成配位键。
①CO分子中σ键与π键数目之比为 ;
②从电负性角度分析,Fe(CO)5中与Fe形成配位键的是 (填“碳”或“氧”)原子。
 ③与羰基铁分子的极性相似的分子是 。
③与羰基铁分子的极性相似的分子是 。
A.SO2 B.CS2 C.BF3 D.PCl3
(3)CH4、H2O分子的键角分别为a、b。则a b
(填>、=或<),原因是 。
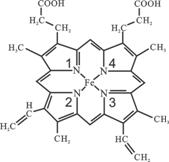
(4)血红素分子结构如右图所示。
①血红素分子间存在的作用力有 (填名称);
②与Fe通过配位键结合的氮原子的编号是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
化学工艺中倡导无污染的绿色化学是一场新的技术革命。若使用单质铜制硝酸铜,下列方案中,耗用原料最经济,而且对环境几乎没有污染的是( )
A.Cu和稀硝酸反应制Cu(NO3)2
B、Cu和浓硝酸反应制Cu(NO3)2
C、铜在空气中受热转化为CuO,再溶于稀硝酸制Cu(NO3)2
D、铜在氧气中受热转化为CuO,再溶于浓硝酸制Cu(NO3)2
查看答案和解析>>
科目:高中化学 来源: 题型:
有A、B、C、D、E五种短周期元素,它们的核电荷数按C、A、B、D、E的顺序增大。C、D都能分别与A按原子个数比为1∶1或2∶1形成化合物;B是短周期中非金属性最强的元素;E的M层电子数是K层电子数的2倍。
(1)写出下列元素的名称:A______,B______,E______。
(2)画出E的原子结构示意图______。
(3)比较EA2与EB4的熔点高低(填化学式)______>______。
(4)A的氢化物的沸点与同族下一周期元素的氢化物相比,A的氢化物的沸点______(填“高”或“低”),原因是______________________________。
(5) 写出电子式D2A2______,EB4______。
查看答案和解析>>
科目:高中化学 来源: 题型:
在10 L的密闭容器中进行反应N2(g) + 3H2(g) 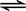 2NH3(g),2 min末N2的物质的量由20 mol减小到8 mol,则2 min末N2的反应速率为
2NH3(g),2 min末N2的物质的量由20 mol减小到8 mol,则2 min末N2的反应速率为
A.1.2 mol/(L·min) B.1 mol/(L·min)
C.0.6 mol/(L·min) D.0.4 mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实能用勒沙特列原理(化学平衡移动原理)解释的是
A.使用催化剂可加快SO2转化为SO3的速率
B.H2、I2、HI平衡混合气加压后颜色变深
C.装有NO2、N2O4平衡混合气的玻璃球在冷水中气体颜色变浅
D.SO2通入氯水,氯水的颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上制备纯硅反应的热化学方程式如下:
SiCl4 (g)+2H2 (g)=Si (s)+4HCl (g) 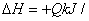 mol(Q>0)
mol(Q>0)
某温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1 mol,则达平衡时,吸收热量为Q kJ
C.反应至4 min时,若HCl浓度为0.12 mol/L, 则H2的反应速率为0.03 mol/(L·min)
D.当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol/L的NaOH溶液恰好反应
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)有如图所示A、B、C、D四种仪器:
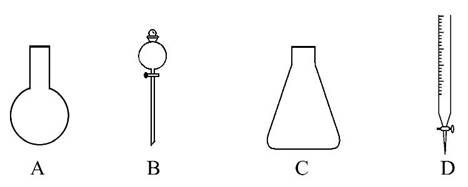
请选择下列仪器名称的序号,填入相应的空格内:
①烧杯 ②碱式滴定管 ③圆底烧瓶 ④锥形瓶
⑤分液漏斗 ⑥酸式滴定管
A________,B________,C________,D________。
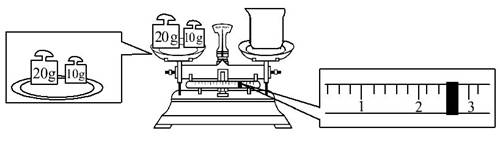
(2)某同学用托盘天平称量烧杯的质量,天平平衡后的状态如图。由图可以看出,该同学在操作时的一个错误是______________。
烧杯的实际质量为________g。
(3)指出下面三个实验中各存在的一个错误:
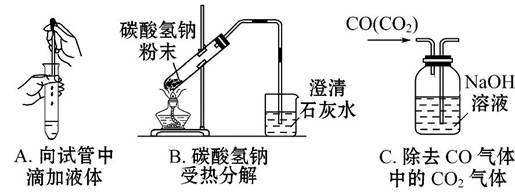
A______________________________________________________________;
B______________________________________________________________;
C______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【化学——物质结构与性质】
H、C、N、O、都属于自然界中常见非金属元素。
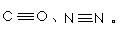 (1)O、C、N三种元素的第一电离能由小到大顺序是 ;NH4+中氮原子轨道的杂化类型为________。
(1)O、C、N三种元素的第一电离能由小到大顺序是 ;NH4+中氮原子轨道的杂化类型为________。
(2)CO、N2的结构可表示为: 两者的键能数据:(单位kJ/mol)
| A—B | A=B |
| |
| CO | 357.7 | 798.9 | 1071.9 |
| N2 | 154.8 | 418.4 | 941.7 |
 结合数据说明CO比N2活泼的原因 。
结合数据说明CO比N2活泼的原因 。
(3)乙二胺(H2N-CH2-CH2-NH2)和三甲胺[N(CH3)3]均属
于胺,但乙二胺比三甲胺的沸点高的多,原因是
。
(4)C、N元素形成的新材料具有如右图所示结构,该晶体
硬度将超过目前世界上最硬的金刚石,成为首屈一指
的超硬新材料。该物质的化学式为: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com