
| Fe3+ | Fe2+ | Zn2+ | |
| 开始沉淀的pH | 1.1 | 5.8 | 5.9 |
| 完全沉淀的pH | 3.2 | 8.8 | 8.9 |
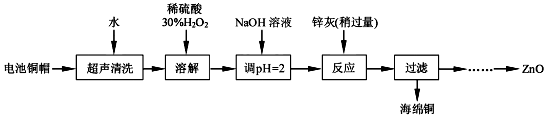
分析 利用废旧电池的铜帽(Cu、Zn总含量约为99%)回收 Cu并制备ZnO,电池铜帽加入水过滤后除去溶于水的杂质,在固体中加入过氧化氢溶解,铜生成硫酸铜溶液,加热煮沸将溶液中过量的H2O2除去,加入氢氧化钠溶液调节溶液PH=2沉淀铁离子,加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物),反应过滤得到海绵铜,沉淀锌离子得到氢氧化锌,分解得到氧化锌,
(1)①酸性条件下Cu与过氧化氢发生氧化还原反应生成硫酸铜和水;
②过氧化氢加热到153℃便猛烈的分解;
(2)①根据淀粉与碘单质作用变蓝解答;
②根据H2O2+2I-+2H+=I2+2H2O解答
(3)滴加H2O2溶液,使Fe2+转化完全为Fe3+,滴加NaOH溶液,形成氢氧化铁沉淀,除杂后形成氢氧化锌沉淀,过滤、洗涤、干燥900℃煅烧制得氧化锌.
解答 解:(1)①铜帽溶解过程中铜发生反应的化学方程式为:Cu+H2O2+H2SO4=CuSO4+2H2O;
故答案为:Cu+H2O2+H2SO4=CuSO4+2H2O;
②过氧化氢性质比较稳定,若加热到153℃便猛烈的分解为水和氧气,将溶液中过量的H2O2 除去可加热至沸;
故答案为:加热(至沸腾);
(2)①淀粉溶液为指示剂,当最后一滴Na2S2O3溶液滴入时,溶液蓝色褪去,且半分钟内不恢复,说明滴定到达终点;
故答案为:淀粉溶液;溶液蓝色褪去,且半分钟内不恢复;
②若留有H2O2,加入KI后,会有以下反应:H2O2+2I-+2H+=I2+2H2O,误当成2Cu2++4I-=2CuI(白色)↓+I2 生成的碘,使测定结果偏高;
故答案为:偏高;
(3)根据表中阳离子沉淀的PH可知,由除去铜的滤液制备ZnO的实验步骤依次为:①向滤液中加入略微过量的30%H2O2,使其充分反应,目的使Fe2+转化完全为Fe3+,②加氢氧化钠溶液,控制PH在3.2~5.9,使Fe3+沉淀完全,③过滤,向滤液中滴加1.0mol•L-1NaOH,调节溶液PH8.9~11,使Zn2+沉淀完全,⑤过滤、洗涤、干燥⑥900℃煅烧,制得氧化锌;
故答案为:①30%的H2O2;②3.2~5.9;④8.9~11.
点评 本题主要考查实验室废弃旧电池的铜帽回收铜和制备ZnO,考查学生对综合实验处理能力,注意实验方案的设计原理和步骤是解答的关键,平时注意打好扎实的基础知识和灵活应用知识解决问题的能力培养,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 4.5 g | B. | 7.2 g | C. | 9.3 g | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某固体中加入稀盐酸,产生了无色气体,证明该固体中一定含有碳酸盐 | |
| B. | 验证溶液中是否含有Cl-,加稀硝酸酸化的AgNO3溶液,有白色沉淀,证明含Cl- | |
| C. | 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ | |
| D. | 某溶液中滴加盐酸酸化的BaCl2溶液,生成白色沉淀,证明一定含有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
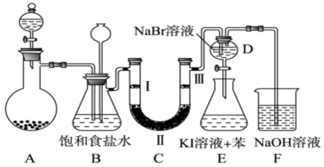
| a | b | c | d | |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 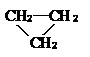 和CH3CH=CH2 和CH3CH=CH2 | B. | 淀粉和纤维素 | ||
| C. | CH3CH2CH2CH3和CH3CH2CH3 | D. | 乙烷和乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
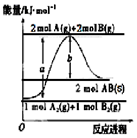
| A. | 该反应热△H=+(a-b)kJ•mol-1 | |
| B. | AB(g)═A(g)+B(g)△H=+b/2kJ•mol-1 | |
| C. | 断裂1 mol A-A键和1 mol B-B键,吸收a kJ能量 | |
| D. | 该反应在任何条件下都不可能自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100ρV/(36.5V+2240) | B. | 1000ρV/(36.5V+2240) | ||
| C. | ρ V/(36.5V+2240) | D. | (1000+36.5ρV)/( 36.5V+2240) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com