
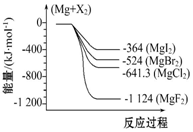
 如图是金属镁和卤素反应的能量变化图(反应物和生成物均为298K时的稳定状态).下列选项中不正确的是( )
如图是金属镁和卤素反应的能量变化图(反应物和生成物均为298K时的稳定状态).下列选项中不正确的是( )| A. | Mg与F2反应放热最多 | |
| B. | MgF2(s)+Br2(l)═MgBr2(s)+F2(g)吸热 | |
| C. | MgBr2与Cl2反应放热 | |
| D. | 化合物的热稳定顺序:MgI2>MgBr2>MgCl2>MgF2 |
分析 由图象可知,Mg与卤素单质的能量高于卤化物,依据能量守恒判断,反应是放热反应,物质的能量越低越稳定,由图象数据分析,化合物的热稳定性顺序为:MgI2<MgBr2<MgCl2<MgF2,以此解答该题.
解答 解:A.依据图象分析判断,Mg与F2的能量高于MgF2,依据能量守恒判断,反应是放热反应,故A正确;
B.Mg(s)+F2(l)=MgF2(s)△H=-1124kJ/mol,Mg(s)+Br2(l)=MgBr2(s)△H=-524kJ/mol,将第二个方程式与第一方程式相减得MgF2(s)+Br2(l)=MgBr2(s)+F2(g);△H=+600kJ•mol-1,为吸热反应,故B正确;
C.氯化镁的能量小于溴化镁的能量,氯气的能量大于溴的能量,所以MgBr2与Cl2反应是放热反应,即△H<0,故C正确;
D.能量越小的物质越稳定,所以化合物的热稳定性顺序为MgI2<MgBr2<MgCl2<MgF2,故D错误.
故选D.
点评 本题考查了热化学方程式书写方法,盖斯定律计算应用,为高考常见题型和高频考点,侧重考查学生的分析能力,注意物质能量与稳定性的关系判断,题目难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 煤油可由石油分馏获得,可用作燃料和保存少量金属钠 | |
| B. | 石油是混合物,其分馏产品汽油为纯净物 | |
| C. | 煤干馏主要得到焦炭、煤焦油、粗氨水和焦炉气 | |
| D. | 石油分馏可获得乙酸、苯及其衍生物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.015 | B. | 0.225 | C. | 0.035 | D. | 0.045 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 微粒半径:Li+<O2-<F-<Na+ | B. | 电负性:F>N>O>C | ||
| C. | 分子中的键角:CO2>H2O>CH4>NH3 | D. | 共价键的键能:H-F>H-Cl>H-Br>H-I |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com