
 ,它可以通过不同的反应得到下列物质:
,它可以通过不同的反应得到下列物质: C.
C. D.
D.
 +H2O.
+H2O.  海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:解答题
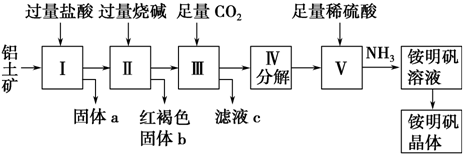
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | ||
| M | Y | |
| Z | N |
| A. | 元素Y与元素Z的最高正化合价之和的数值等于13 | |
| B. | 元素Z的含氧酸的酸性比元素N的强 | |
| C. | 离子半径的大小顺序为Z(n+1)->M(n+1)->Yn- | |
| D. | Z的气态氢化物的还原性和热稳定性均比N强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子数之比为3:2 | B. | 同温同压下密度比是2:3 | ||
| C. | 同温同压下质量比是3:2 | D. | 标准状况下体积比是2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解时,阳极反应为:Fe-2e-=Fe2+ | |
| B. | 电解过程中阴极能产生氢气 | |
| C. | 电解过程中,Cr2O72-在阳极放电 | |
| D. | 电解过程中,溶液中生成Cr(OH)3和Fe(OH)3沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 强电解质 | C | NaCl | CaCO3 | HNO3 |
| 弱电解质 | CH3COOH | NH3 | HCl | H2O |
| 非电解质 | 蔗糖 | BaSO4 | C2H5OH | 酒精 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉保存在密闭容器中 | B. | 新制氯水保存在棕色瓶中 | ||
| C. | AgBr保存在普通玻璃试剂瓶中 | D. | 往液溴中加少量水并密封保存 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com