

| NaCN |
 ,反应②先发生开环加成反应,然后再被氯原子取代羟基得到1,4-二氯丁烷,反应③发生信息中反应,-Cl原子被-CN取代得到B为
,反应②先发生开环加成反应,然后再被氯原子取代羟基得到1,4-二氯丁烷,反应③发生信息中反应,-Cl原子被-CN取代得到B为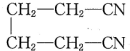 ,反应④为B与氢气发生加成反应得到己二胺,反应⑤为水解反应,己二胺与己二酸发生缩聚反应得到尼龙
,反应④为B与氢气发生加成反应得到己二胺,反应⑤为水解反应,己二胺与己二酸发生缩聚反应得到尼龙 ;
;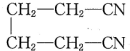 ,可知乙酰胺脱水得到乙腈(CH3C≡N);
,可知乙酰胺脱水得到乙腈(CH3C≡N); ,反应②先发生开环加成反应,然后再被氯原子取代羟基得到1,4-二氯丁烷,反应③发生信息中反应,-Cl原子被-CN取代得到B为
,反应②先发生开环加成反应,然后再被氯原子取代羟基得到1,4-二氯丁烷,反应③发生信息中反应,-Cl原子被-CN取代得到B为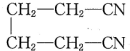 ,反应④为B与氢气发生加成反应得到己二胺,反应⑤为水解反应,己二胺与己二酸发生缩聚反应得到尼龙
,反应④为B与氢气发生加成反应得到己二胺,反应⑤为水解反应,己二胺与己二酸发生缩聚反应得到尼龙 ,
, ,B的结构简式为
,B的结构简式为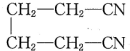 ,故答案为:
,故答案为: ;
;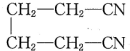 ;
; ,
, ,
, ;
; ;
;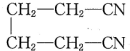 ,可知乙酰胺制备乙腈(CH3C≡N)的化学方程式为:CH3CONH2
,可知乙酰胺制备乙腈(CH3C≡N)的化学方程式为:CH3CONH2 | 一定条件 |
| 一定条件 |


科目:高中化学 来源: 题型:
| A、向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- |
| B、Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O |
| C、向次氯酸钠溶液中通入足量SO2气体:ClO-+SO2+H2O═HClO+HSO3- |
| D、NaHSO4溶液与Ba(OH)2溶液反应至中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加热胆矾失去结晶水,得到白色的无水硫酸铜,这一过程叫风化 |
| B、家用石碱(Na2CO3?10H2O)久置后,有块状变成粉末状,这一变化是风化的结果 |
| C、白色的无水硫酸铜粉末遇水形成蓝色的硫酸铜那个晶体,这一过程叫潮解 |
| D、从冰箱中取出物品,表面很快出现水珠,这种现象叫潮解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| c(H+) | c(S
| c(Fe2+、Fe3+) | ||
| O | 2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、常温下,M能与银氨溶液发生反应 |
| B、④的反应类型属于酯化反应,不属于取代反应 |
| C、用饱和碳酸钾溶液能鉴别乙醇、乙酸和乙酸乙酯 |
| D、淀粉和纤维素的化学式均为(C6H10O5)n,二者互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、5.4% | B、8.0% |
| C、16.3% | D、16.4% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com