
| A. | △H4=(△H1+△H2-3△H3)×$\frac{1}{3}$ | B. | △H4=(3△H3-△H1-△H2)×$\frac{2}{3}$ | ||
| C. | △H4=(△H1+△H2-3△H3)×$\frac{2}{3}$ | D. | △H4=(△H1-△H2-3△H3)×$\frac{3}{2}$ |
分析 利用盖斯定律分析,不管化学反应是一步或分几步完成,其反应热是不变的;根据目标方程改写分方程,然后计算出2S(g)═S2(g)的焓变△H4即可.
解答 解:根据目标方程,把方程③反写,计量数乘以2;把方程②乘以$\frac{2}{3}$;把方程①乘以$\frac{2}{3}$,然后三者相加可得:2S(g)═S2(g)△H4=-△H3×2+△H2×$\frac{2}{3}$+△H1×$\frac{2}{3}$=$\frac{2}{3}$(△H1+△H2-3△H3),
故选C.
点评 本题考查了反应热与焓变的应用,题目难度不大,根据盖斯定律构造目标热化学方程式为解答关键,注意掌握盖斯定律的内容及使用方法,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | NaHSO4溶液与Ba(OH)2溶液反应至中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| B. | Mg(OH)2与H2SO4反应:Mg2++2OH-+2H++SO42-═MgSO4↓+2H2O | |
| C. | 镁与醋酸反应 Mg+2H+═Mg2++H2↑ | |
| D. | Na2SO3溶液使酸性KMnO4溶液褪色:5SO32-+6H++2MnO4-═5SO42-+2Mn2++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
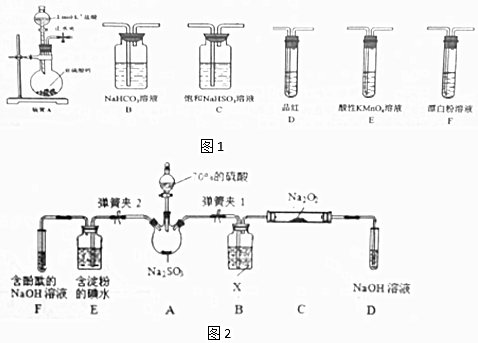
| 操作步骤 | 实验现象 | 解释原因 |
| 关闭弹簧夹2,打开弹簧夹1,注入硫酸至浸没三颈烧瓶中固体 | 若将带火星的木条放在D试管口处,木条不复燃 | SO2与Na2O2反应无O2生成,可能发生的化学反应方程式为①Na2O2+SO2=Na2SO4 |
| 若将带火星的木条放在D试管口处,木条复燃 | SO2与Na2O2反应有O2生成,发生的化学反应为:2SO2+2Na2O2═2Na2SO3+O2 | |
| 关闭弹簧夹1,打开弹簧夹2,残余气体进入E,F中. | E中②E 中溶液蓝色褪去 | E中反应的离子方程式③SO2+I2+2H2O=2I-+SO42-+4H+ |
| F中④F 中红色变浅或褪色 | F中反应为2OH-+SO2═SO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标况下,22.4升的H2O含有的水分子数为NA | |
| B. | 标况下,11.2升CCl4中含有的Cl原子数为2NA | |
| C. | 17克NH3中含有的电子总数为10NA | |
| D. | 0.5mol/L的H2SO4溶液中含有的H+数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 一定条件下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H<-38.6 kJ•mol-1 | |
| B. | 中和热的测定实验中需要用的主要玻璃仪器:两个大小相同的烧杯、两个大小相同的量筒、温度计、环形玻璃搅拌棒,也可以用保温杯代替烧杯做有关中和热测定的实验 | |
| C. | 在测定中和热的实验中,至少需要测定并记录的温度是3次 | |
| D. | CO(g)的燃烧热是283.0 kJ•mol-1,则CO2分解的热化学方程式为:2CO2(g)═2CO(g)+O2(g)△H=+283.0 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| HClO | HSCN | H2CO3 |
| K=3.2×10-8 | K=0.13 | K1=4.3×10-7 K2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单斜硫转化为正交硫需要吸热 | B. | 单斜硫比正交硫稳定 | ||
| C. | △H4>△H5 | D. | △H4<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在含有弱电解质的溶液中,往往有多个化学平衡共存.
在含有弱电解质的溶液中,往往有多个化学平衡共存.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com