
 +2Cu(OH)2+NaOH$\stackrel{△}{→}$
+2Cu(OH)2+NaOH$\stackrel{△}{→}$ +Cu2O↓+3H2O.
+Cu2O↓+3H2O. .
. 和
和 .
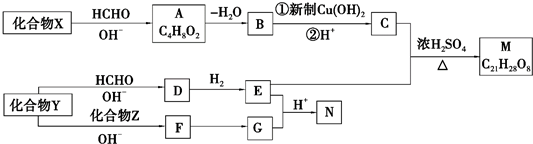
. 分析 有机物X与HCHO发生信息i的反应,结合A的分子式为C4H8O2可知,X为CH3CH2CHO,A为HOCH2CH(CH3)CHO,A发生消去反应脱去1分子H2O生成B,故B为CH2═C(CH3)CHO,B氧化生成C为CH2═C(CH3)COOH;Y与甲醛在碱性条件下生成D,D与氢气加成得E,由信息iii中N的结构及E和G反应生成N可知,E为 ,G为
,G为 ,根据转化关系,可逆推得Y为CH3CHO,Z为
,根据转化关系,可逆推得Y为CH3CHO,Z为 ,故F为
,故F为 ,D为
,D为 ,根据信息ii中反应,结合M的分子式C21H28O8可知,M的物质为
,根据信息ii中反应,结合M的分子式C21H28O8可知,M的物质为 ,据此分析解答.
,据此分析解答.
解答 解:有机物X与HCHO发生信息i的反应,结合A的分子式为C4H8O2可知,X为CH3CH2CHO,A为HOCH2CH(CH3)CHO,A发生消去反应脱去1分子H2O生成B,故B为CH2═C(CH3)CHO,B氧化生成C为CH2═C(CH3)COOH;Y与甲醛在碱性条件下生成D,D与氢气加成得E,由信息iii中N的结构及E和G反应生成N可知,E为 ,G为
,G为 ,根据转化关系,可逆推得Y为CH3CHO,Z为
,根据转化关系,可逆推得Y为CH3CHO,Z为 ,故F为
,故F为 ,D为
,D为 ,根据信息ii中反应,结合M的分子式C21H28O8可知,M的物质为
,根据信息ii中反应,结合M的分子式C21H28O8可知,M的物质为 ,
,
(1)由上述分析可知,A为HOCH2CH(CH3)CHO,含有羟基、醛基,A→B是HOCH2CH(CH3)CHO发生消去反应脱去1分子H2O生成CH2═C(CH3)CHO,
故答案为:羟基、醛基;消去反应;
(2)由上述分析可知,Z的结构简式是 ,名称是苯甲醛,故答案为:苯甲醛;
,名称是苯甲醛,故答案为:苯甲醛;
(3)M的物质为 ,1molM在一定条件下发生加成反应,最多消耗 4molH2,故答案为:4;
,1molM在一定条件下发生加成反应,最多消耗 4molH2,故答案为:4;
(4)B为CH2═C(CH3)CHO,由B生成C的反应①的化学方程式为 +2Cu(OH)2+NaOH$\stackrel{△}{→}$
+2Cu(OH)2+NaOH$\stackrel{△}{→}$ +Cu2O↓+3H2O,
+Cu2O↓+3H2O,
故答案为: +2Cu(OH)2+NaOH$\stackrel{△}{→}$
+2Cu(OH)2+NaOH$\stackrel{△}{→}$ +Cu2O↓+3H2O2O;
+Cu2O↓+3H2O2O;
(5)Y为CH3CHO,由Y生成D的化学方程式为CH3CHO+3HCHO$\stackrel{OH-}{→}$ ,故答案为:CH3CHO+3HCHO$\stackrel{OH-}{→}$
,故答案为:CH3CHO+3HCHO$\stackrel{OH-}{→}$ ;
;
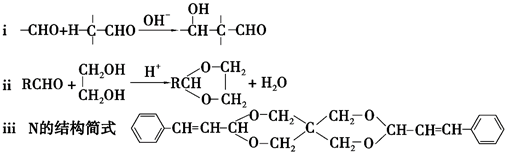
(6)G为 ,G的同分异构体仍含有C=C和-CHO,符合条件的同分异构体有如下4种:
,G的同分异构体仍含有C=C和-CHO,符合条件的同分异构体有如下4种: 、
、 、
、 、
、 ,其中
,其中 和
和 核磁共振氢谱有5组峰值,且峰值比为2:2:2:1:1的结构简式,
核磁共振氢谱有5组峰值,且峰值比为2:2:2:1:1的结构简式,
故答案为:4; 和
和 .
.
点评 本题考查有机推断与合成,为高频考点,侧重考查学生分析推断及知识迁移能力,明确物质之间的转化、反应条件及题给信息是解本题关键,充分利用给出的反应信息及有机物的结构、分子式确定X、E、G的结构简式,题目难度中等.


科目:高中化学 来源: 题型:解答题
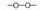 ,需要在有机合成中引入羟基,引入羟基的反应类型有①②⑤.(选填编号)
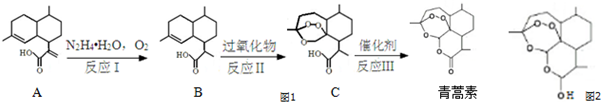
,需要在有机合成中引入羟基,引入羟基的反应类型有①②⑤.(选填编号)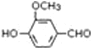 )可用于合成青蒿素,合成天然香草醛的反应如图:
)可用于合成青蒿素,合成天然香草醛的反应如图: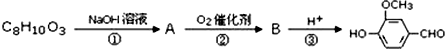
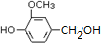 .
.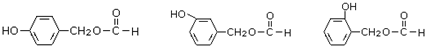 .
.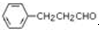 是合成青蒿素的中间原料之一,写出由苯甲醛和氯乙烷为原料,制备苄基乙醛的合成路线流程图(无机试剂任用).
是合成青蒿素的中间原料之一,写出由苯甲醛和氯乙烷为原料,制备苄基乙醛的合成路线流程图(无机试剂任用).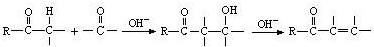
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 干冰用于人工降雨 | |
| B. | 蔗糖中加入浓硫酸,蔗糖变黑,体积膨胀 | |
| C. | 溶洞中钟乳石的形成 | |
| D. | 豆科作物的根瘤菌对空气中氮的固定 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
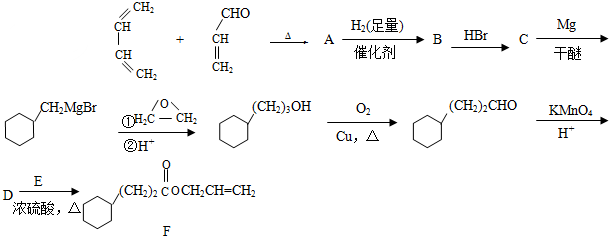
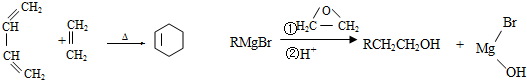
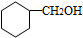 .
. .
. .
.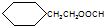
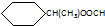 .
.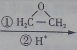 CH3CH2CH2CH2OH(其他试剂任选).
CH3CH2CH2CH2OH(其他试剂任选).查看答案和解析>>
科目:高中化学 来源: 题型:推断题
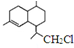 为原料合成B,写出其合成路线(指明所用试剂和反应条件).
为原料合成B,写出其合成路线(指明所用试剂和反应条件).查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油裂解主要目的是得到短链的不饱和烃 | |
| B. | 煤中含有苯和甲苯,可用先干馏后分馏的方法将它们分离出来 | |
| C. | 煤的气化与液化都是化学变化 | |
| D. | 含C18以上烷烃的重油经过催化裂化可以得到汽油 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com