
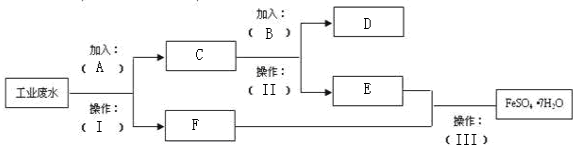
分析 某工厂的工业废水中含有大量的FeSO4、较多的Cu2+和少量的Na+,先加过量铁(A),过滤,得到F溶液为FeSO4,C为Cu和多余的铁,再向C中加过量稀硫酸,过滤得到的D为Cu,E为FeSO4,以此解答该题.
解答 解:某工厂的工业废水中含有大量的FeSO4、较多的Cu2+和少量的Na+,先加过量铁(A),过滤,得到F溶液为FeSO4,C为Cu和多余的铁,再向C中加过量稀硫酸,过滤得到的D为Cu,E为FeSO4,由此可知A为铁,操作Ⅱ为过滤,用于分离固体和溶液,
故答案为:D.
点评 本题考查了工艺流程图的分析判断,解答本题要充分理解各种物质的性质,从而得出正确的结论,应熟悉混合物的分离方法,掌握过滤和蒸发结晶分离方法的使用条件及实验操作,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | c(H+)/c(OH-)=1012的溶液中:NH4+、Al3+、NO3-、Cl- | |
| B. | 无色溶液中:Mg2+、MnO4-、SO42-、K+ | |
| C. | 酸性溶液中可能大量存在Na+、ClO?、SO42?、I? | |
| D. | 通入足量CO2后的溶液中:Na+、SiO32-、CH3COO-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 密闭、低温是存放氨水的必要条件 | |
| B. | 实验室常用排饱和食盐水法收集氯气 | |
| C. | 打开汽水瓶时,有大量气泡冒出 | |
| D. | 已知合成氨的反应为N2(g)+3H2(g)?2NH3(g)△H=-92.4 kJ/mol,工业上采用较高温度和使用催化剂以提高氨气的产率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 雾是气溶胶,在阳光下可观察到丁达尔效应 | |
| B. | 预制备Fe(OH)3胶体,向盛有沸水的烧杯中加入FeCl3饱和溶液煮沸得红褐色沉淀 | |
| C. | 用石膏或卤水点制豆腐利用了胶体的性质 | |
| D. | 用鸡蛋壳膜和蒸馏水除去淀粉胶体中的食盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用25mL碱式滴定管量取高锰酸钾溶液,体积为16.60mL | |
| B. | 用标准NaOH溶液滴定未知浓度盐酸,用去NaOH溶液20.50mL | |
| C. | 用10mL量筒量取8.25mL盐酸 | |
| D. | 用普通pH试纸测得某溶液pH为3.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Cu2+、Cl-、SO42- | B. | Fe3+、K+、SO42-、NO3- | ||
| C. | H+、Mg2+、OH-、NO3- | D. | Na+、Ca2+、Cl-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
温度/K | 298 | 398 | 498 | … |
| 平衡常数(K) | 4.1×105 | K1 | K2 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/K | 反应I | 反应Ⅱ | 已知: K1>K2>K1′>K2′ |
| 298 | K1 | K2 | |
| 328 | K1′ | K2′ |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com