
【题目】向浓硫酸中分别加入下列三种固体,对实验现象的分析正确的是( )
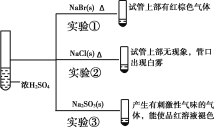
A.对比实验①和②可知还原性:Br->Cl-
B.对比实验①和③可知氧化性:Br2>SO2
C.对比实验②和③可知酸性:H2SO4>HCl>H2SO3
D.由实验可知浓硫酸具有强酸性、难挥发性、氧化性、脱水性
【答案】A
【解析】
A. 实验①生成棕色气体是溴蒸气,实验②白雾是氯化氢,说明浓硫酸能将溴离子氧化成溴单质,而不能将氯离子氧化成氯气,与同一种氧化剂在相同条件下反应,溴离子被氧化成溴单质,而氯离子不能被氧化,说明还原性:Br>Cl,A正确;
B. 实验③生成是二氧化硫气体,非氧化还原反应,而且亚硫酸钠与溴化钠不是同一类型,所以不能比较Br2、SO2的氧化性,B错误;
C. 实验②白雾说明氯化氢易挥发,不能说明酸性H2SO4>HCl,而实验③生成是二氧化硫气体,非氧化还原反应,而是强酸制弱酸,能说明H2SO4>H2SO3,C错误;
D. 实验中不能得知浓硫酸具有脱水性,D错误;故答案为:A。


科目:高中化学 来源: 题型:
【题目】由下述实验现象,下列氯水对应结论不正确的是
实验 | 装置 | 试剂 A | 现象 |
① |
| 紫色石蕊溶液 | 先变红后褪色 |
② | 滴有 KSCN 的 FeCl2 溶液 | 溶液变红 | |
③ | NaHCO3 溶液 | 产生使澄清石灰水变浑浊的气体 | |
④ | HNO3 酸化的 AgNO3 溶液 | 产生白色沉淀 |
A.①氯水具有酸性和漂白性
B.②氯水具有还原性
C.③氯水中含有 H+
D.④氯水中含有 Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨和硝酸都是重要的工业原料。
(1)标准状况下,将500 L氨气溶于水形成1 L氨水,则此氨水的物质的量浓度为__mol· L-1(保留三位有效数字)。工业上常用过量氨水吸收二氧化硫,该反应的化学方程式为__。
(2)氨氧化法是工业生产中合成硝酸的主要途径。合成的第一步是将氨和空气的混合气通过灼热的铂铑合金网,在合金网的催化下,氨被氧化成一氧化氮,该反应的化学方程式为__。
下列反应中的氨与氨氧化法中的氨作用相同的是__。
A.2Na+2NH3===2NaNH2+H2↑ B.2NH3+3CuO===3Cu+N2+3H2O
C.4NH3+6NO===5N2+6H2O D.HNO3+NH3===NH4NO3
工业中的尾气(假设只有NO和NO2)用烧碱进行吸收,反应的离子方程式为2NO2+2OH﹣===NO2-+NO3-+H2O和NO+NO2+2OH﹣===□ +H2O(配平该方程式)。______________
(3)向27.2 g Cu和Cu2O的混合物中加入某浓度的稀HNO3500 mL,反应过程中产生的气体只有NO。固体完全溶解后,在所得溶液(金属阳离子只有Cu2+)中加入1 L 1 mol·L-1的NaOH溶液使金属离子恰好完全沉淀,此时溶液呈中性,所得沉淀质量为39.2 g。
①Cu与稀HNO3反应的离子方程式为__。
②Cu与Cu2O 的物质的量之比为__。
③HNO3的物质的量浓度为__mol·L-1。
(4)有H2SO4和HNO3的混合溶液20 mL,加入0.25 molL﹣1Ba(OH)2溶液时,生成沉淀的质量w(g)和Ba(OH)2溶液的体积V(mL)的关系如图所示(C 点混合液呈中性)。则原混合液中H2SO4的物质的量浓度为__mol·L-1,HNO3的物质的量浓度为__mol·L-1。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用偏铝酸钠(NaA1O2)溶液电解法制备氢氧化铝的简易装置如图所示,其中两电极均为惰性电极。下列说法正确的是( )
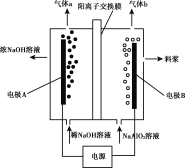
A.电极A为阳极
B.气体b为H2
C.所得料浆液的pH大于原料NaA1O2溶液的pH
D.该方法总反应方程式是:4NaA1O2+10H2O![]() 4A1(OH)3+4NaOH+O2↑+2H2↑
4A1(OH)3+4NaOH+O2↑+2H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海带含有大量的碘,每1000g海带中含碘5g左右。实验室中,从海藻里提取碘的部分流程如下图。
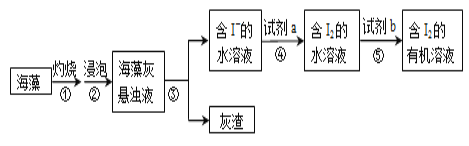
(1)③的操作名称是_______,所需的玻璃仪器有:_______⑤的操作名称是_______。
(2)试剂b可以是四氯化碳,还可以是_______(填名称)。选择四氯化碳的理由是:_____
(3)关于⑤的操作步骤,下列说法正确的是__________(填字母)。
A 振荡液体时,需要倒转分液漏斗
B 充分振荡液体后,将分液漏斗放置在铁架台上,立即分液
C 分液时,上下层液体都要从分液漏斗下口沿着烧杯内壁流入不同的烧杯
D 分液时,需要塞紧分液漏斗上方的玻璃塞,使分液漏斗密封
(4)试剂a可选用稀硫酸酸化的过氧化氢溶液,补全步骤④反应的离子方程式:
_____I― +______H2O2+_________=_______I2+_________。(系数为“1”时,要写“1”)
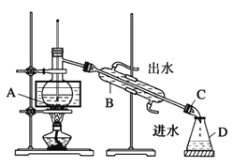
(5)某兴趣小组设计实验方案,从含I2的CCl4溶液中分离I2和CCl4。已知:
物质 | 熔点 | 沸点 |
I2 | 114℃ | 184℃ |
CCl4 | -23℃ | 77℃ |
①小组同学根据资料,采用了蒸馏的方法,组装了如下图装置,仪器B的名称是_____,②图中有一个明显错误,应改正为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.23gNO2与足量水反应,转移的电子数约为6.02×1023
B.标准状况下,22.4L15NH3含有的质子数约为6.02×1024
C.常温下,1L0.1mo1L-1NH4NO3溶液中含有的NH4+数约为6.02×1022
D.密闭容器中,1molNO与0.5molO2充分反应后,容器中分子数约为6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式为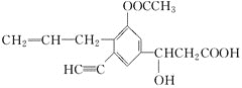 ,分析其结构,并回答下列问题:
,分析其结构,并回答下列问题:
(1)写出其分子式:____________________________________________。
(2)其中含有____个不饱和碳原子,分子中有____个双键。
(3)分子中的极性键有__________(写出2种即可)。
(4)分子中的饱和碳原子有______个,一定与苯环处于同一平面的碳原子有______个。
(5)分子中C—C===O键角约为__________,H—C≡C键角约为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某溶液中含有SO42-、CO32-、Cl-,若只允许取一次该溶液而把三种离子分别检验出来,则应采取的措施是:
①先加入_____________检验_____________________;
②然后加入_________________,检验_____________;
③最后加入______________检验____________________________。
(2)阅读、分析下列两个材料:
材料一、(见图)
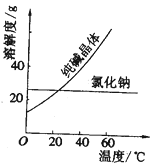
材料二、
物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm3 | 溶解性 |
乙二醇( C2H6O2) | 11.5 | 198 | 1.11 | 易溶于水和乙醇 |
丙三醇(C3H8O3) | 17.9 | 290 | 1.26 | 能跟水、酒精以任意比互溶 |
回答下列问题(填写序号):
A.蒸馏法 B.萃取法
C.“溶解、结晶、过滤”的方法 D.分液法
①纯碱从氯化钠和纯碱的混合物中分离出来,最好应用______。
②将乙二醇和丙三醇相互分离的最佳方法是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com