
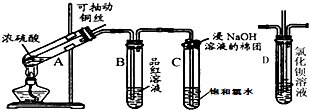
 如图是研究铜与浓硫酸的反应装置:
如图是研究铜与浓硫酸的反应装置:| 资料1 |
| ||||||||||||
| 资料2 | X射线晶体分析表明,铜与浓硫酸反应生成的黑色物质为Cu2S、CuS、Cu7S4中的一种或几种. |
分析 (1)A装置中是铜和浓硫酸加热方式反应生成硫酸铜、二氧化硫和水;
(2)生成的二氧化硫具有漂白性分析,二氧化硫的漂白作用是形成不稳定的无色物质;
(3)饱和氯水和二氧化硫反应,C试管口的棉花是防止二氧化硫、氯气挥发到空气中污染空气,试管C口部的棉团浸有NaOH,可与二氧化硫反应防止污染空气;
(4)可通过抽动铜丝控制反应,证明A试管中反应所得产物是否含有铜离子的操作方法是利用铜离子在溶液中呈蓝色;
(5)图表数据分析铜和浓硫酸反应过程中会生成黑色物质证明有副反应,浓度合适会避免黑色固体出现,浓度越大,温度越高黑色越难消失.
解答 解:(1)A装置中是铜和浓硫酸加热方式反应生成硫酸铜、二氧化硫和水,反应的化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(2)生成的二氧化硫具有漂白性,二氧化硫的漂白作用是形成不稳定的无色物质,品红溶液由红色变成无色;
故答案为:溶液由红色变成无色;
(3)饱和氯水和二氧化硫反应,C试管口的棉花是防止二氧化硫、氯气挥发到空气中污染空气,试管C口部的棉团浸有NaOH,可与二氧化硫反应防止污染空气;
故答案为:吸收Cl2和SO2,防止污染空气;
(4)可通过抽动铜丝控制反应,证明A试管中反应所得产物是否含有铜离子的操作方法是利用铜离子在溶液中呈蓝色,向上拉铜丝,终止反应,冷却后,将A中溶液慢慢倒入盛有少量水的烧杯(试管)里,观察溶液颜色是否为蓝色证明是否生成铜离子;
故答案为:向上拉铜丝,终止反应,冷却后,将A中溶液慢慢倒入盛有少量水的烧杯(试管)里,观察溶液颜色是否为蓝色证明是否生成铜离子;
(5)依据图表数据分析可知,浓度不同时出现黑色物质的时间随浓度增大减小,浓度为18mol/L时生成的黑色物质不能消失;
a.分析过程可知.发生的反应过程中生成二氧化硫和硫酸铜的反应过程中有奇谈反应发生生成黑色物质,铜与浓硫酸反应时所涉及的反应可能不止一个,故a正确;
b.图表数据可知硫酸浓度选择适当,小于15mol/L,可避免最后产物中出现黑色物质,故b正确;
c.浓硫酸和铜的反应浓度小于15mol/L也可能出现黑色物质,出现的时间长,该反应发生的条件不一定是硫酸浓度≥15mol•L-1,故c错误;
d.图表数据中,18mol/L的浓硫酸,出现褐色物质的时间短,黑色物质难以消失,所以硫酸浓度越大,黑色物质越快出现、越难消失,故d正确;
故答案为:abd.
点评 本题考查了物质性质实验方案的设计,题目难度中等,涉及浓硫酸与铜反应、二氧化硫的漂白性、氧化性的实验验证、污染气体的实验处理、二氧化硫的还原性和酸性氧化物的性质应用等知识,注意掌握浓硫酸的性质、二氧化硫的性质及检验方法,(2)为难点,充分考查了学生的分析、理解能力及灵活应用基础知识的能力.


 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:解答题
 单质、氧化物、酸、碱和盐的相互关系,可以用图简单表示,限选择铁、碳、氧气、盐酸、氧化钙、二氧化碳、水、氢氧化钙8种物质作为反应物,将图中指定序号的转变用化学方程式表示(所写化学方程式不得重复).
单质、氧化物、酸、碱和盐的相互关系,可以用图简单表示,限选择铁、碳、氧气、盐酸、氧化钙、二氧化碳、水、氢氧化钙8种物质作为反应物,将图中指定序号的转变用化学方程式表示(所写化学方程式不得重复).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 密闭容器中气体的平均相对分子质量不变则该反应达到平衡状态 | |
| B. | 20℃时,氨基甲酸铵的分解平衡常数为2.048×10-9mol3•L-3 | |
| C. | 恒温下压缩体积,NH3的体积分数不变 | |
| D. | 再加入一定量氨基甲酸铵,可加快正反应反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图所示的装置,C、D、E、F、X、Y都是惰性电极.接通电源后,向乙中滴入酚酞溶液,在F极附近显红色.试回答下列问题:
如图所示的装置,C、D、E、F、X、Y都是惰性电极.接通电源后,向乙中滴入酚酞溶液,在F极附近显红色.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烷、丁烯 | B. | 乙炔、丙烷 | C. | 乙烷、乙烯 | D. | 乙炔、乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 西维因是一种芳香烃 | |
| B. | 西维因分子中所有碳原子一定共面 | |
| C. | 可用FeCl3溶液检验西维因是否发生水解 | |
| D. | 在Ni催化加热条件下西维因不能与H2加成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
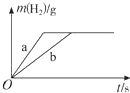
| A. | 曲线a为K,b为Na | |
| B. | 稀盐酸一定不足量 | |
| C. | 投入Na、K一定等质量 | |
| D. | 投入Na的物质的量小于K的物质的量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com