
【题目】锂的某些化合物是性能优异的材料。请回答:
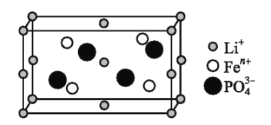
(1)如图是某电动汽车电池正极材料的晶胞结构示意图,其化学式为 ______ ,其中![]() 的基态电子排布式为 ______ ,
的基态电子排布式为 ______ ,![]() 的空间构型为 ______ 。
的空间构型为 ______ 。
(2)![]() 与Na中第一电离能较小的元素是 ______ ;LiF与NaCl晶体中熔点较高的是 ______ 。
与Na中第一电离能较小的元素是 ______ ;LiF与NaCl晶体中熔点较高的是 ______ 。
(3)氮化锂是一种良好的储氢材料,其在氢气中加热时可吸收氢气得到氨基锂![]() 和氢化锂,氢化锂的电子式为 ______ ,上述反应的化学方程式为 ______。
和氢化锂,氢化锂的电子式为 ______ ,上述反应的化学方程式为 ______。
(4)金属锂为体心立方晶胞,其配位数为 ______ ;若其晶胞边长为apm,则锂晶体中原子的空间占有率是 ______ 。
(5)有机锂试剂在有机合成中有重要应用,但极易与![]() 、
、![]() 等反应.下列说法不正确的是 ______
等反应.下列说法不正确的是 ______ ![]() 填字母序号
填字母序号![]() 。
。
A.CO2中σ键与π键的数目比为1:1
B.游离态和化合态锂元素均可由特征发射光谱检出
C.叔丁基锂(C4H9Li)中碳原子的杂化轨道类型为sp3和sp2。
【答案】![]()
![]() 正四面体 Na LiF
正四面体 Na LiF ![]() :
:![]()
![]() 8
8 ![]() C
C
【解析】
![]() 对于平行六面体晶胞而言,用均摊法计算的依据是:①处于顶点的微粒,同时为8个晶胞所共用,每个微粒有1/8属于该晶胞;②处于棱上的微粒,同时为4个晶胞所共用,每个微粒有1/4属于该晶胞;③处于面上的微粒,同时为2个晶胞所共用,每个微粒有1/2属于该晶胞;④处于晶胞内部的微粒,完全属于该晶胞,据此分析解答;价层电子对数=
对于平行六面体晶胞而言,用均摊法计算的依据是:①处于顶点的微粒,同时为8个晶胞所共用,每个微粒有1/8属于该晶胞;②处于棱上的微粒,同时为4个晶胞所共用,每个微粒有1/4属于该晶胞;③处于面上的微粒,同时为2个晶胞所共用,每个微粒有1/2属于该晶胞;④处于晶胞内部的微粒,完全属于该晶胞,据此分析解答;价层电子对数=![]() 键电子对数+孤电子对数,孤电子对数
键电子对数+孤电子对数,孤电子对数![]() ,(其中a为中心原子的价电子数,x为与中心原子结合的原子个数,b为与中心原子结合的原子最多接受的电子数),根据价层电子互斥理论即可得出空间构型,据此分析作答;
,(其中a为中心原子的价电子数,x为与中心原子结合的原子个数,b为与中心原子结合的原子最多接受的电子数),根据价层电子互斥理论即可得出空间构型,据此分析作答;
![]() 同一主族自上而下第一电离能逐渐减小;离子晶体的熔沸点由晶格能的大小决定,而离子晶体的晶格能则由离子所带电荷和离子半径共同决定。电荷多、半径小的离子晶体晶格能大,熔沸点高,据此分析;
同一主族自上而下第一电离能逐渐减小;离子晶体的熔沸点由晶格能的大小决定,而离子晶体的晶格能则由离子所带电荷和离子半径共同决定。电荷多、半径小的离子晶体晶格能大,熔沸点高,据此分析;
![]() 氢化锂属于离子化合物,据此写出电子式;陌生方程式的书写根据题干信息确定反应物和生成物,然后配平即可;
氢化锂属于离子化合物,据此写出电子式;陌生方程式的书写根据题干信息确定反应物和生成物,然后配平即可;
![]() 体心立方晶胞的晶体,配位数为8;晶胞体对角线长度为原子半径的4倍,晶胞体对角线长度为晶胞棱长的
体心立方晶胞的晶体,配位数为8;晶胞体对角线长度为原子半径的4倍,晶胞体对角线长度为晶胞棱长的![]() 倍,原子的空间占有率为原子所占体积除以晶胞的体积,据此解答;
倍,原子的空间占有率为原子所占体积除以晶胞的体积,据此解答;
![]() 双键含有1个
双键含有1个![]() 键、1个
键、1个![]() 键,而一个二氧化碳分子含二个双键,据此作答;每种原子都有自己的特征谱线,游离态和化合态均可由特征发射光谱检出,据此作答;叔丁基锂(C4H9Li) 中碳原子的杂化方式可类比有机C原子的杂化方式,有机物中C原子的杂化方式规律为:单键C原子为SP3杂化,一个双键为SP2杂化,一个叁键为SP杂化,据此作答;
键,而一个二氧化碳分子含二个双键,据此作答;每种原子都有自己的特征谱线,游离态和化合态均可由特征发射光谱检出,据此作答;叔丁基锂(C4H9Li) 中碳原子的杂化方式可类比有机C原子的杂化方式,有机物中C原子的杂化方式规律为:单键C原子为SP3杂化,一个双键为SP2杂化,一个叁键为SP杂化,据此作答;
![]() 根据均摊法可知,晶胞中
根据均摊法可知,晶胞中![]() 数目为
数目为![]() ,
,![]() 数目为4,
数目为4,![]() 离子数目为4,根据化合价代数和为0,可知
离子数目为4,根据化合价代数和为0,可知![]() ,故化学式为:
,故化学式为:![]() ,
,![]() 的核外电子排布式为
的核外电子排布式为![]() ,
,![]() 中P原子孤电子对数
中P原子孤电子对数![]() ,价层电子对数
,价层电子对数![]() ,空间构型为正四面体;
,空间构型为正四面体;
故答案为:![]() ;
;![]() ;正四面体;
;正四面体;
![]() 同主族自上而下第一电离能减小,故第一电离能
同主族自上而下第一电离能减小,故第一电离能![]() ,离子所带电荷相同,离子半径
,离子所带电荷相同,离子半径![]() 、
、![]() ,故LiF的晶格能大于NaCl的,故LiF的沸点较高;
,故LiF的晶格能大于NaCl的,故LiF的沸点较高;
故答案为:Na;LiF;
![]() 氢化锂属于离子化合物,由锂离子与氢负离子构成,电子式为
氢化锂属于离子化合物,由锂离子与氢负离子构成,电子式为![]() :
:![]() ,氮化锂在氢气中加热时可吸收氢气得到氨基锂
,氮化锂在氢气中加热时可吸收氢气得到氨基锂![]() 和氢化锂,反应方程式为:
和氢化锂,反应方程式为:![]() ;
;
故答案为:![]() :
:![]() ;
;![]() ;
;
![]() 金属锂为体心立方晶胞,体心Li原子与晶胞顶点Li原子相邻,则配位数为8;晶胞中Li原子数目为
金属锂为体心立方晶胞,体心Li原子与晶胞顶点Li原子相邻,则配位数为8;晶胞中Li原子数目为![]() ,晶胞体对角线长度为Li原子半径的4倍,晶胞体对角线长度为晶胞棱长的
,晶胞体对角线长度为Li原子半径的4倍,晶胞体对角线长度为晶胞棱长的![]() 倍,设Li原子半径为r,则晶胞棱长为
倍,设Li原子半径为r,则晶胞棱长为![]() ,故原子的空间占有率
,故原子的空间占有率 ;
;
故答案为:![]() ;
;
![]() 的结构式为
的结构式为![]() ,单键为
,单键为![]() 键,双键含有1个
键,双键含有1个![]() 键、1个
键、1个![]() 键,
键,![]() 键与
键与![]() 键的数目比为1:1 ;故A正确;
键的数目比为1:1 ;故A正确;
B.每种原子都有自己的特征谱线,游离态和化合态锂元素均可由特征发射光谱检出,故B正确;
C.叔丁基锂![]() 中碳原子的杂化轨道数目均为4,碳原子采取
中碳原子的杂化轨道数目均为4,碳原子采取![]() 杂化,故C错误;
杂化,故C错误;
故选:C;


科目:高中化学 来源: 题型:
【题目】(1)25℃时,浓度为0.1 mol·L-1的6种溶液:①HCl, ②CH3OOH, ③Ba(OH)2,④Na2CO3,⑤KCl,⑥NH4Cl溶液pH由小到大的顺序为__________________(填写编号)。
(2)25℃时,醋酸的电离常数Ka=1.7×10-5mol/L,则该温度下CH3COONa的水解平衡常数Kh=_________mol ·L-1(保留到小数点后一位)。
(3)25℃时,pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后,溶液呈_________(填“酸性”,“中性”或“碱性”) ,请写出溶液中离子浓度间的一个等式:________________________________。
(4)25℃时,将m mol/L的醋酸和n mol/L的氢氧化钠溶液等体积混合后,溶液的pH=7,则溶液中c(CH3COO-) + c(CH3COOH)=______,m与n的大小关系是m_____n(填“ >”“=”或“<”)。
(5)25℃时,将等体积、等物质的量浓度的醋酸与氨水混合后,溶液的pH=7 ,则NH3·H2O的电离常数Ka=______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把煤作为燃料可通过下列两种途径获得热量:
途径Ⅰ:C(s)+O2(g)═CO2(g) △H1<0 ①
途径Ⅱ:先制成水煤气:C(s)+H2O(g)═CO(g)+H2(g) △H2>0 ②
再燃烧水煤气:2CO(g)+O2(g)═2CO2(g) △H3<0 ③
2H2(g)+O2(g)═2H2O(g) △H4<0 ④
请回答下列问题:
(1)途径Ⅰ放出的热量理论上____(填“大于”、“等于”或“小于”)途径Ⅱ放出的热量。
(2)途径Ⅱ在制水煤气的反应里,反应物所具有的总能量____生成物所具有的总能量(填“大于”、“等于”或“小于”),因此在反应时,反应物就需要___能量才能转化为生成物。
(3)途径I中通常将煤块粉碎、经脱硫处理、在适当过量的空气中燃烧,这样处理的目的是______
①使煤充分燃烧,提高能量的转化率 ②减少SO2的产生,避免造成“酸雨”
③减少有毒的CO产生,避免污染空气 ④减少CO2的产生,避免“温室效应”
(4)△H1、△H2、△H3、△H4的数学关系式是____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种不同浓度的NaOH溶液,c(H+)分别为1×10-14 mol/L 和1×10-10 mol/L。将此两溶液等体积混合后,所得溶液中的c(H+)是( )
A.1×(10-14+10-10) mol/LB.![]() mol/L
mol/L
C.2×10-10 mol/LD.2×10-14 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苹果酸(a-羟基丁二酸)是一种健康食品饮料,结构为: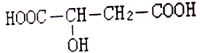 ,下列关于苹果酸的说法不正确的是
,下列关于苹果酸的说法不正确的是
A. 在铜或银作催化剂条件下加热,能与氧气反应
B. 在一定条件下能形成环状有机化合物
C. 在氢氧化钠的乙醇溶液中加热,能发生消去反应
D. 能发生缩聚反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室从含碘废液(含有H2O 、CCl4、I2、I-等)中回收碘,操作过程如下:
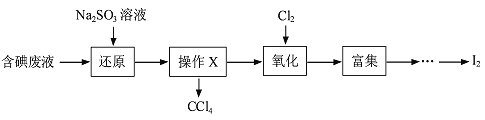
(1)向废液中加入Na2SO3溶液,发生“还原”反应的离子方程式为____________。
(2)“氧化”操作在三颈烧瓶中进行(如图一),将溶液用盐酸调至pH约为2,缓慢通入Cl2。实验用水浴控制在40℃左右的较低温度下进行的原因是_______。
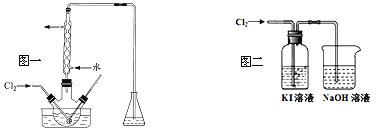
(3)某研究小组用图二装置对Cl2与KI溶液的反应进行探究,发现通入Cl2一段时间后,KI溶液变为黄色,继续通入Cl2,则溶液黄色变浅,最后变为无色。研究小组对所得无色溶液中碘元素的存在形态提出了以下假设:
假设一:没有I2形态;假设二:没有I-形态;假设三:有IO3-形态。
①请设计实验证明假设一成立(试剂自选)。
实验操作 | 预期现象 | 结论 |
___________________ | 假设一成立 |
②若假设三成立,请写出生成IO3-的离子方程式__________________________________。
(4)该研究小组还进行了对加碘盐中KIO3含量测定的如下实验:
①准确称取加碘盐m g于烧杯中,加入适量蒸馏水和过量的KI,再滴入适量的稀硫酸,充分反应,将所得混合液配成250.00mL待测溶液。移取25.00mL待测溶液于锥形瓶中,加几滴淀粉试液,用c molL-1Na2S2O3标准液滴定至终点,重复3次,测得平均值为V mL。
已知:IO3-+ 5I-+6H+ =3H2O+3I2,I2 +2S2O32-=2I-+S4O62-。测定时,判断达到滴定终点的现象为___________。由测定数据可求得该样品中含KIO3的质量分数为___________(用含m、c、V的代数式表示,Mr(KIO3)=214 )。
②在滴定操作正确无误的情况下,用此种测定方法测得的结果往往偏高,其原因是受空气的影响,请用离子方程式表示产生这一影响的原因_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.现有下列物质①100 ℃纯水②25 ℃ 0.1 mol/L HCl溶液③25 ℃ 0.1 mol/L KOH溶液④25 ℃ 0.1 mol/L Ba(OH)2溶液。
(1)这些物质与25 ℃纯水相比,能促进水电离的是________(填序号,下同),能抑制水的电离的是________,水电离的c(OH-)等于溶液中c(OH-)的是________,水电离的c(H+)等于溶液中c(H+)的是________。
(2)②和③溶液中水的电离度相等,进而可推出的结论是:同一温度下,___________时,水的电离度相等。
II.今有①盐酸②醋酸③硫酸三种稀溶液,用序号回答下列问题。
(1)若三种酸的物质的量浓度相等,三种溶液中的c(H+)大小关系为______
(2)若三种溶液的c(H+)相等,三种酸的物质的量浓度大小关系为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图所示实验,回答问题:

(1)实验①观察到的现象是________________________。
(2)实验②观察到的现象是________________________。

(3)实验③观察到的现象是________________________。实验④观察到的现象是________________________。
(4)由上述实验,你能得出的结论是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
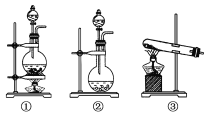
【题目】为了探究Cl2、SO2同时通入H2O中发生的反应,某校化学兴趣小组同学设计了如图所示的实验装置。
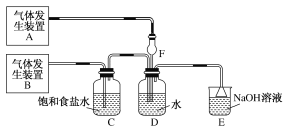
(1)该化学兴趣小组的同学为制取Cl2、SO2气体,现采用Na2SO3与70%的硫酸为原料制取SO2,采用MnO2和浓盐酸(12 mol·L-1)为原料制取Cl2。在此实验中,F仪器的作用是________;发生装置B应选择以下三种装置中的________(选填序号)。
(2)D装置中主要反应的离子方程式为_______________________
(3)为验证通入D装置中的气体是Cl2过量还是SO2过量,兴趣小组的同学准备了以下试剂:
①氯化铁溶液 ②氯化亚铁溶液 ③硫氰化钾溶液 ④品红溶液 ⑤酸性高锰酸钾溶液
若Cl2过量,取适量D中溶液滴加至盛有________(选填一个序号)试剂的试管内,再加入________(选填一个序号)试剂。发生的现象是______________。若SO2过量,取适量D中溶液滴加至盛有________(选填一个序号)试剂的试管内,发生的现象是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com