
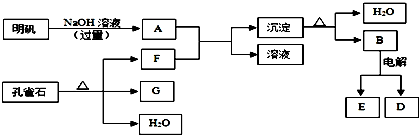
分析 (1)铝和镁的碱式碳酸盐分解吸热,生成二氧化碳可隔绝空气;
(2)实验一中减少的是二氧化碳气体和水蒸气的质量,灼烧得到固体为氧化铝和氧化镁的混合物;
实验二中生CO2的体积为112mL(标准状况),可以计算碳酸根离子的物质的量;
实验三中的1.74g白色沉淀为氢氧化镁沉淀,据此可计算出镁离子的物质的量,然后结合实验计算出3.01g该碱式盐中铝离子的物质的量;
再根据电荷守恒计算出碱式盐中含有的氢氧根离子的物质的量,最后根据质量守恒定律计算出碱式盐中含有水的物质的量,从而得出该碱式盐的化学式.
解答 解:(1)铝和镁的碱式碳酸盐分解吸热,降低燃烧温度,且生成二氧化碳可隔绝空气,可起到灭火的作用,同时生成高熔点的MgO、Al2O3,起到隔绝氧气的作用,
故答案为:反应分解吸收热量,有水生成吸收热量,有二氧化碳生成隔绝空气,生成高熔点的MgO、Al2O3;
(2)①如灼烧不充分,则实验一剩余固体质量偏大,实验二可确定氢氧化镁的质量,则测得含铝质量偏大,则Mg2+与Al3+的物质的量之比会偏小,
故答案为:偏小;
②3.01g碱式碳酸盐中,含:n(Mg2+)=n[Mg(OH)2]=$\frac{1.74g}{58g/mol}$=0.03mol,依据Al2O3和MgO质量为3.01g-1.30g=1.71g,依据元素守恒计算得到
n(Al3+)=2n(Al2O3)=$\frac{2×(3.01-1.30-0.03×40)}{102}$=0.01mol,
n(CO32-)=n(CO2)=0.005mol,
n(OH-)=(0.03×2+0.01×3-0.005×2)=0.08mol,
n(H2O)=$\frac{(1.30-0.04×18-0.005×44)}{18}$=0.02mol,
所以n(Al3+):n(Mg2+):n(OH-):n(CO32-):n(H2O)=0.01mol:0.03mol:0.08mol:0.005mol:0.02mol=2:6:16:1:4,
即碱式碳酸盐的化学式为:Al2Mg6(OH)16CO3•4H2O,
答:达喜的化学式为Al2Mg6(OH)16CO3•4H2O.即碱式碳酸盐的化学式为:Al2Mg6(OH)16CO3•4H2O.
点评 本题考查复杂化学式的计算等知识,难度中等,全面考查了学生的分析、理解能力和化学计算能力,注意把握实验的原理,从守恒的角度计算..


 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 石油破裂的主要目的是得到乙烯 | |
| B. | 有机物结构的分析方法有核磁共振法、红外光谱法、质谱法和紫外光谱法等 | |
| C. | 李比希提出基团的概念,并首次使用无机盐合成尿素,突破了有机物与无机物的界限 | |
| D. | 糖类、油脂、蛋白质是人类重要营养物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
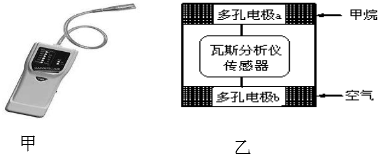
| A. | 电极b是正极,内电路中O2-由电极b流向电极a | |
| B. | 电极a的反应式为:CH4+4O2--8e-═CO2+2H2O | |
| C. | 瓦斯分析仪工作时,电池内电路中电子由电极b流向电极a | |
| D. | 当固体电解质中有1mol O2-通过时,电子转移2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 以甲烷为燃料的新型电池,其成本大大低于以氢为燃料的传统燃料电池,目前得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图.回答下列问题:
以甲烷为燃料的新型电池,其成本大大低于以氢为燃料的传统燃料电池,目前得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的溶液中:Fe2+、NO3-、Cl-、Na+ | |
| B. | Na2S溶液中:SO42-、K+、Cl-、Cu2+ | |
| C. | c(H+)=1.0×10-13 mol•L-1溶液中:C6H5O-、K+、SO42-、Br- | |
| D. | 能使甲基橙呈红色的溶液中:Na+、AlO2-、NO3-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液中:K+、Fe2+、Cl-、NO3- | |
| B. | 含有大量Fe3+的溶液:Na+、Mg2+、NO3-、SCN- | |
| C. | pH=12的溶液中:K+、NH4+、SO42-、NO3- | |
| D. | 水电离产生的c(OH-)=1×10-14mol•L-1:K+、Na+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在即将到来的新能源时代,核能、太阳能、氢能将成为主要能源 | |
| B. | 中、美、日等国已掌握的陶瓷发动机技术,能较大程度地降低能耗,节约能源 | |
| C. | 光缆在信息产业中有广泛应用,制造光缆的主要材料是单质硅 | |
| D. | 结构陶瓷碳化硼(B4C3)常用于制造切削工具,它是一种新型无机非金属材料,属于原子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com