
下列叙述错误的是
A.乙烯和苯都能使溴水褪色,褪色的原理相同
B.淀粉、油脂、蛋白质都能水解,但水解产物不同
C.乙酸乙酯中的少量乙酸可用饱和Na2CO3溶液除去
D.煤油可由石油分馏获得,可用作燃料和保存少量金属钠
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源:2013-2014山西大学附中高三第二学期5月理科综合化学试卷(解析版) 题型:填空题
(15分)氮的化合物在无机化工领域有着重要的地位。请回答下列问题:
(1)基态氮原子的价电子排布图为______。氮的最高价氧化物为无色晶体,它由两种离子构成:已知其阴离子构型为平面正三角形,则其阳离子的构型为 形,阳离子中氮的杂化轨道类型为 。
(2)某氮铝化合物X具有耐高温、抗冲击、导热性好等优良性质,广泛用于陶瓷工业等领域。工业上用氮气与氧化铝和碳在一定条件下反应生成X和CO,X的晶体结构如图所示,工业制备X的化学方程式为____。
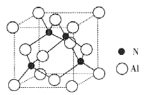
(3)X晶体中包含的化学键类型为______。(填字母标号)
A.离子键 B.共价键 C.配位键 D.金属键
(4)已知氮化硼与X晶体类型相同,且氮化硼的熔点比X高,可能的原因是______
(5)若X的密度为pg/cm3,则晶体中最近的两个N原子的距离为______cm(阿伏加德罗常数用NA表示,不必化简)。
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省潍坊市高三4月模拟考试理综化学试卷(解析版) 题型:计算题
(17分)随着我国工业化水平的不断发展,解决水、空气污染问题成为重要课题。
(1)汽车尾气的大量排放是造成空气污染的重要因素之一,发展燃料电池汽车可以有效地解决上述问题。直接甲醇燃料电池(DMFC)不会产生有害产物,能量转换效率比内燃机要高2~3倍,电池结构如图所示,c处通入的物质为为______,外电路中电子从______到______(填“A”或“B”)移动,写出电池负极的电极反应方程式
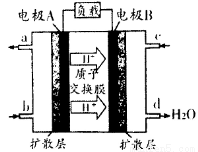
(2)工业废水中常含有一定量的Cr2O72-,会对人类及生态系统产生很大损害,电解法是处理铬污染的常用方法。该法用Fe做电极电解含Cr2O72-的酸性废水,电解时,在阴极上有大量气泡生成,并产生Cr(OH)3、Fe(0H)3沉淀。
①反应中,1molCr2O72-完全生成Cr(OH)3沉淀,外电路通过电子的物质的量为_________ mol。
②常温下,Cr(OH)3的溶度积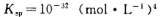 ,当Cr3+浓度小于10
,当Cr3+浓度小于10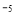 mol
mol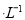 时可认为完全沉淀,电解完全后,测得溶液的pH=6,则该溶液过滤后为___________(填“能”或“否”)直接排放。
时可认为完全沉淀,电解完全后,测得溶液的pH=6,则该溶液过滤后为___________(填“能”或“否”)直接排放。
(3)含氨废水易引发水体富营养化。向NH4Cl溶液中加入少量NaOH固体,溶液中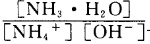 ________(填“增大”“减小”或“不变”);25
________(填“增大”“减小”或“不变”);25 时,NH3?H2O的电离平衡常数
时,NH3?H2O的电离平衡常数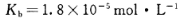 ,该温度下,1mol
,该温度下,1mol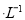 的NH4Cl溶液中
的NH4Cl溶液中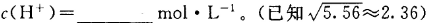
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省潍坊市下学期期中考试高二化学试卷(解析版) 题型:选择题
普伐他汀是一种调节血脂的药物,其结构简式如图所示(未表示出其空间构型)。下列关于普伐他汀的描述正确的是
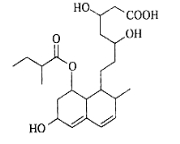
A.分子中含有3种官能团
B.可发生加成反应、氧化反应
C.在水溶液中羧基和羟基均能电离出H+
D.1 mol该物质最多可与l molNaOH反应
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省潍坊市下学期期中考试高二化学试卷(解析版) 题型:选择题
某有机化合物的结构简式为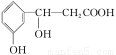 ,它可以发生的反应类型有
,它可以发生的反应类型有
①取代反应 ②加成反应 ③消去反应 ④酯化反应 ⑤水解反应 ⑥中和反应
A.①③④⑥ B.②⑤⑥
C.①②③④⑥ D.全部
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省潍坊市下学期期中考试高一化学试卷(解析版) 题型:简答题
(14分)某同学探究同周期元素性质递变规律时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验步骤”与“实验现象”前后不一定是对应关系)。
实验步骤 | 实验现象 |
①将镁条用砂纸打磨后,放入沸水中;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,做不定向运动,随之消失,溶液变成红色 |
②向新制得的Na2S溶液中滴加新制氯水 | B.有气体产生,溶液变成浅红色 |
③将金属钠放入滴有酚酞溶液的冷水中 | C.剧烈反应,迅速产生大量无色气体 |
④将镁条投入稀盐酸中 | D.反应较快,产生无色气体 |
⑤将铝条投入稀盐酸中 | E. 生成白色胶状沉淀,继而沉淀消失 |
⑥向AlCl3溶液中滴加NaOH溶液至过量 | F.生成淡黄色沉淀 |
请你帮助该同学整理并完成实验报告。
(1)实验目的:研究同周期元素性质递变规律。
(2)实验用品:试剂:金属钠,镁条,铝条,稀盐酸,新制氯水,新制Na2S溶液,
AlCl3溶液,NaOH溶液等。
仪器: , ,烧杯,试管,试管夹,镊子,小刀,玻璃片等。
(3)实验内容:(完成实验步骤对应的实验现象的标号和离子方程式)
实验步骤 | 实验现象 | 离子方程式 |
① |
| (不需填写) |
② |
|
|
③ |
|
|
④ | C | (不需填写) |
⑤ | D |
|
⑥ |
|
|
(4)实验结论:从左向右,同周期元素原子的失电子能力递减,得电子能力递增。
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省潍坊市下学期期中考试高一化学试卷(解析版) 题型:选择题
下列物质中,化学键类型完全相同的是
A.CaBr2与HCl B.MgCl2与Na2S
C.KOH与NaCl D.H2O与NaCl
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省淄博市高三第三次模拟考试理综化学试卷(解析版) 题型:填空题
(17分)H2O2是一种强氧化剂,被广泛应用于水处理及卫生消毒等方面。
(1)H2O2不稳定,当其中含Fe2+时,会发生反应:
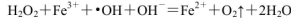 ,则Fe2+在此过程中所起的作用是______________,当生成336mL O2(标准状况)时,反应中转移电子的物质的量为_______mol。
,则Fe2+在此过程中所起的作用是______________,当生成336mL O2(标准状况)时,反应中转移电子的物质的量为_______mol。
(2)下表是在常压、60℃和不同pH条件下,6mL30% H2O2在60min内释放出氧气的体积。则下列说法正确的是___________。
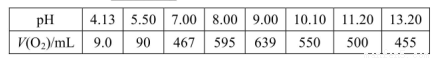
a.pH越大,H2O2的分解速率越大
b.pH在9左右,H2O2的分解速率最大
c.6mL 30% H2O2分解最多释放出的氧气的体积为639mL
d. pH=5.50时,0~60min内,v(O2)=1.5mL
(3)溶液中H2O2的残留量可用一定浓度的酸性KMnO4溶液来测定,反应中MnO4-
被还原为Mn2+,该反应的离子方程式为______________。
(4)科学工作者以Ir-Ru/Ti为阳极、ACFC为阴极,在酸性环境、不断通入空气的条件下直接电解水来制备H2O2。电解过程中,阳极区溶液的pH_ (填“增大”“不变”或“减小”),阴极产生H2O2的电极反应式为_______。若不通空气,则阴极得到的产物是_______ 。
(5)己知断裂1mol化学键所需的能量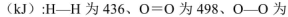
143,H-O为463。则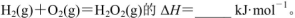 .
.
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省济宁市高一5月质量检测化学试卷(解析版) 题型:选择题
反应H2(g)+ I2(g) 
 2HI(g)在体积固定的密闭容器中进行,达到平衡状态的标志是( )
2HI(g)在体积固定的密闭容器中进行,达到平衡状态的标志是( )
①单位时间内断裂n mol H-H键的同时形成2n mol H-I键 ②单位时间内生成n molI2的同时生成2n molHI
A.②④⑤⑥ B.②③④⑤ C.①③④⑤ D.全部
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com