
������һ����Ҫ�Ļ�����Ʒ����������Ρ����صȵ�ԭ�ϡ���ҵ�ϳɰ��ķ�Ӧ����:N2(g) +3H2(g)  2NH3(g) ��H=һ92. 4 KJ��mol-1
2NH3(g) ��H=һ92. 4 KJ��mol-1
��1��2NH3(g)  N2(g) +3H2(g)�ں����ܱ������дﵽƽ��ı�־��
N2(g) +3H2(g)�ں����ܱ������дﵽƽ��ı�־��
�ٵ�λʱ��������3n mol H2:ͬʱ����2n mol NH3����NH3��N2��H2��ʾ��Ӧ���ʱ�Ϊ2��1��3 �ۻ��������ܶȲ��ٸı� �ܻ������ѹǿ���ٸı� �ݻ������ƽ����Է����������ٸı�
| A���٢ۢ� | B���٢ڢܢ� | C���٢ܢ� | D���ڢۢ� |

| ʱ�䣯min | ��0 | 30 | 70 | 80 | 100 |
| n(CO2) ��mol | 0.10 | 0.060 | 0.040 | 0.040 | 0.040 |
21.��1��C; ��2����>;������76.53��B��CO(NH2)2 -6e- + 8OH- = CO32- + N2 +6H2O
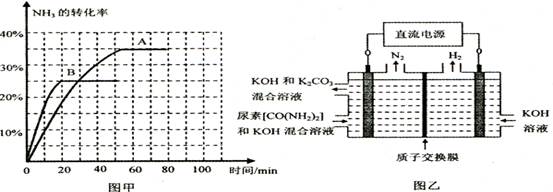
������������� ��1�� �ٵ�λʱ��������3n mol H2:ͬʱ����2n mol NH3,�൱��ͬһ���ʵ����淴Ӧ������ȣ���ȷ������NH3��N2��H2��ʾ��Ӧ���ʱ�Ϊ 2��1��3 ��������ƽ���û��ƽ�������ϵ�����������ۻ��������ܶȲ��ٸı䣬�������������������У������������䣬�����ܶ�һֱ���䣬������Ϊƽ���ж����ݣ����� �����������ʵ�����Ӧǰ�����ı䣬�������ѹǿ���ٸı�ʱ������Ϊ�ж����ݣ���ȷ�� �ݻ������ƽ����Է��������������������������ʵ������������䵫�����ʵ��������ı䣬�����ٸı�ʱ˵���ﵽƽ�⣬��ȷ����2��������û�дﵽƽ�⣬ƽ����������Ӧ����ʱ���У�����20 minʱ����(CO2 )Ӧ�ô���80 minʱ������100 minʱ�����������������䣬���������г���0. 050 mo1CO2��0. 20 molNH3���൱�ڿ�ʼ�����˷�Ӧ������0. 150 mo1CO2��0. 60 molNH3�������Ǻ����������൱��������ѹǿƽ�����ƣ����½���ƽ���CO2��ת������ԭƽ����Ƚ����۸�����̬�����Լ���Ϊ��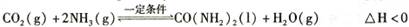
��ʼ��0.1 0.4 0 0
ת����0.06 0.12 0.06 0.06
ƽ�⣺0.04 0.28 0.06 0.06
�������淴Ӧ��ƽ�ⳣ��ΪK=0.03*0.03/0.142*0.02=76.53������t�浽(t+10)���������¶�ƽ�������ƶ���������ת���ʽ��ͣ���ѡ��ȷ��ͼ�������B�����ڵ�����������ӦӦ����ʧ���ӵģ�Ӧ�����ɵ������ʵ缫��ӦΪCO(NH2)2 -6e- + 8OH- = CO32- + N2 +6H2O���������������ɣ����ݵ����غ㣬����������1mol����ʱ����Ӧ����3mol�������ɣ�������1mol��������ʱ��������е���0.25mol,��������0.25mol,�������15g��
���㣺���⿼���˻�ѧƽ��״̬���жϣ���Ŀ�ѶȲ�����ע����ջ�ѧƽ��״̬�жϵĽǶȣ��ر������淴Ӧ���ʵĹ�ϵ��Ϊ�״��㡣



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��ҵ���û�ѧ����������Ʊ�������,�䷴Ӧ����:3SiCl4(g)+2N2(g)+6H2(g) Si3N4(s)+12HCl(g)����H<0
Si3N4(s)+12HCl(g)����H<0
ij�¶Ⱥ�ѹǿ������,�ֱ�0.3 mol SiCl4(g)��0.2 mol N2(g)��0.6 mol H2(g)����2 L�ܱ�������,����������Ӧ,5 min�ﵽƽ��״̬,����Si3N4(s)��������5.60 g��
(1)H2��ƽ����Ӧ�������������� mol��L-1��min-1��
(2)ƽ��ʱ������N2��Ũ������������ mol��L-1��
(3)SiCl4(g)��ת����������������
(4)����n(SiCl4)��n(N2)��n(H2)=3��2��6��Ͷ�����,���������������������,SiCl4(g)��ת����Ӧ��������(�������С�����䡱)��
(5)�ڲ��ı䷴Ӧ�����������,Ϊ�����SiCl4(g)��ת����,��ͨ���ı�Ͷ����ȵķ�ʽ��ʵ�֡���������Ͷ�Ϸ�ʽ,���п��е�������������
| ѡ�� | Ͷ�Ϸ�ʽ |
| A | n(SiCl4)��n(N2)��n(H2)=1��1��2 |
| B | n(SiCl4)��n(N2)��n(H2)=" " 1��2��2 |
| C | n(SiCl4)��n(N2)��n(H2)=" " 3��2��2 |
| D | n(SiCl4)��n(N2)��n(H2)=" " 2��1��3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��Դ����������������ٵ��ش���⣬�״���һ�ֿ�������Դ�����п�����Ӧ�õĹ���ǰ�����о��״�������Ҫ���塣
��1����CO�ϳɼ״��ķ�ӦΪ��CO(g)+2H2(g)  CH3OH(g)���ݻ�Ϊ1L�����ܱ������зֱ����1molCO��2molH2��ʵ���ü״������ʵ������¶ȡ�ʱ��Ĺ�ϵ������ͼ��ʾ���������Ӧ�ġ�H_______0�����������������=�������жϵ�������______��
CH3OH(g)���ݻ�Ϊ1L�����ܱ������зֱ����1molCO��2molH2��ʵ���ü״������ʵ������¶ȡ�ʱ��Ĺ�ϵ������ͼ��ʾ���������Ӧ�ġ�H_______0�����������������=�������жϵ�������______��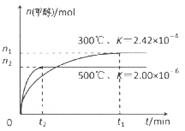
��2�����ù�ҵ�����е�CO2����ȡ�״����䷴ӦΪ��CO2+3H2 CH3OH+H2O��
CH3OH+H2O��
�ٳ��³�ѹ����֪���з�Ӧ�������仯����ͼ��ʾ��
�ɶ�����̼�������Ʊ��״����Ȼ�ѧ����ʽΪ_______��
��Ϊ̽����CO2����ȼ�ϼ״��ķ�Ӧԭ�����ֽ�������ʵ�飺��һ���º����ܱ������У�����1molCO2��3molH2������������Ӧ�����CO2����CH3OH(g)��Ũ����ʱ��仯��ͼ��ʾ���ӷ�Ӧ��ʼ��ƽ�⣬v(H2)="_______" �����¶��µ�ƽ�ⳣ����ֵK=______����ʹƽ����ϵ��n(CH3OH)/n(CO2))����Ĵ�ʩ��_______����дһ������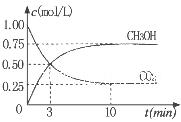
��3����ҵ�����ü״��Ʊ������ij��÷��������֡�
�ټ״���������������Ҫ��ӦΪ��CH3OH(g)  CO(g)+2H2(g)�����ݻ�Ϊ2.0L���ܱ������г���0. 60 molCH3OH(g)����ϵѹǿΪP1����һ�������´ﵽƽ��ʱ����ϵѹǿΪP2����P2/P1 =2.2�����������CH3OH ��ƽ��ת����Ϊ______ ��
CO(g)+2H2(g)�����ݻ�Ϊ2.0L���ܱ������г���0. 60 molCH3OH(g)����ϵѹǿΪP1����һ�������´ﵽƽ��ʱ����ϵѹǿΪP2����P2/P1 =2.2�����������CH3OH ��ƽ��ת����Ϊ______ ��
�ڼ״���������������һ���¶�����Ag/CeO2��ZnOΪ����ʱԭ���������Է�Ӧ��ѡ���ԣ�ѡ����Խ��ʾ���ɵĸ�����Խ�ࣩӰ���ϵ��ͼ��ʾ����n(O2)��n(CH3OH) =0.25ʱ��CH3OH��O2��������Ҫ��Ӧ����ʽΪ______ �����Ʊ�H2��ʱ��ÿ���n(O2))/n(CH3OH)=______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��E��F����̶��ݻ����ܱ������У���һ�������·�����Ӧ��
E(g)+F(s) 2G(g)�����Թ��������ƽ��ʱG���������(%)���¶Ⱥ�ѹǿ�ı仯���±���ʾ��
2G(g)�����Թ��������ƽ��ʱG���������(%)���¶Ⱥ�ѹǿ�ı仯���±���ʾ��
| ѹǿ/MPa �������/% �¶�/�� | 1.0 | 2.0 | 3.0 |
| 810 | 54.0 | a | b |
| 915 | c | 75.0 | d |
| 1000 | e | f | 83.0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��ҵ��һ�����ܱ������в������з�Ӧ�ϳɼ״���CO(g)+2H2(g)  CH3OH(g)
CH3OH(g)
��1����ͬ�¶��µ�ƽ��ת������ѹǿ�Ĺ�ϵ��ͼ��ʾ��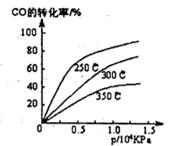
�ٸ÷�Ӧ��H 0����S 0(�>����<��)����÷� �Է����У��һ���ܡ�����һ�����ܡ�������һ������ʵ����������������250�桢l.3��l04kPa���ң�ѡ���ѹǿ�������� ��
��2��ij�¶��£���2molCO��6molH2����2L���ܱ������У���ַ�Ӧ�ﵽƽ��ʱ���c(CO)="0.l" mol·L -1��
�ٸ÷�Ӧ��ƽ�ⳣ��K= ��
���������������������£����������ѹ����ԭ����1/2����ԭƽ����ȣ������й�˵����ȷ���� ������ţ���
| A��������Ũ�ȼ��� |
| B������Ӧ���ʼӿ죬�淴Ӧ����Ҳ�ӿ� |
| C���״������ʵ������� |
| D������ƽ��ʱn(H2)/n(CH3OH)���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��ӦaA+bB  cC�����Ϊ2L�������н��з�Ӧ���ڢ����ϵ�и����ʵ�����ʱ��仯����������ͼ��ʾ��
cC�����Ϊ2L�������н��з�Ӧ���ڢ����ϵ�и����ʵ�����ʱ��仯����������ͼ��ʾ��
��ش����и��⣺
��1����Ӧ�Ļ�ѧ����ʽΪ_____________________________
��2��A��ƽ����Ӧ����vI(A)��v��(A)��v��(A)�Ӵ�С���д���Ϊ________________
��3���ɼ����֪���ڢ��20����ʱ��C��ƽ������vI(C)=____________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
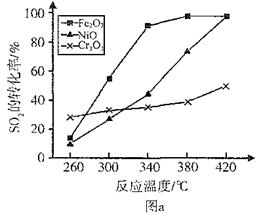
��һ�������£���һ�ݻ��ɱ���ܱ������У���SO2��O2��Ϸ�����Ӧ��
2SO2(g)��O2(g) 2SO3(g) ��H����92.3KJ/mol����Ӧ�����У�SO2��O2��SO3�����ʵ���(mol)�ı仯���±���0��4minʱ����������ѹǿΪ0.1MPa����
2SO3(g) ��H����92.3KJ/mol����Ӧ�����У�SO2��O2��SO3�����ʵ���(mol)�ı仯���±���0��4minʱ����������ѹǿΪ0.1MPa����
| ʱ��min | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| n(SO2) | 2.00 | 1.92 | 1.84 | 1.76 | 1.76 | 1.64 | 1.52 | 1.40 | 1.40 | 1.40 |
| n(O2) | 1.00 | 0.96 | 0.92 | 0.88 | 0.88 | 0.82 | 0.76 | 0.70 | 0.70 | 0.70 |
| n(SO3) | 0 | 0.08 | 0.16 | 0.24 | 0.24 | 0.36 | 0.48 | 0.60 | 0.60 | 0.60 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�����ٷɻ���ƽ�������ʱ��β���е� ���ƻ������㡣��ѧ�������о����ô�������β���е�
���ƻ������㡣��ѧ�������о����ô�������β���е� ��
��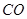 ת���
ת��� ��
�� ����ѧ����ʽ��2NO+2CO
����ѧ����ʽ��2NO+2CO 2CO2+N2
2CO2+N2
Ϊ�˲ⶨ��ij�ִ��������µķ�Ӧ���ʣ���ij�¶��������崫������ò�ͬʱ���NO��COŨ�ȣ�mol��L-1�������
| ʱ��/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c��NO�� | 1.00��10-3 | 4.50��10-4 | 2.50��10-4 | 1.50��10-4 | 1.00��10-4 | 1.00��10-4 |
| c��CO�� | 3.60��10-3 | 3.05��10-3 | 2.85��10-3 | 2.75��10-3 | 2.70��10-3 | 2.70��10-3 |
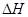 0�����>������<������=������
0�����>������<������=������ ��
��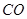 ת���
ת��� ��
�� �ķ�Ӧ���ʵ��� ��
�ķ�Ӧ���ʵ��� ��| ʵ���� | T/�� | NO��ʼŨ�� | CO��ʼŨ�� | �����ȱ����/m2��g-1 |
| �� | 280 | 1.20��10-3 | 5.80��10-3 | 82 |
| �� | | | | 124 |
| �� | 350 | | | 124 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��1�����ܱ������н������з�Ӧ��M(g) + N(g)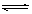 R(g) + 2L(?)���˷�Ӧ���ɷ�����ͼͼ��
R(g) + 2L(?)���˷�Ӧ���ɷ�����ͼͼ��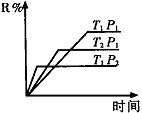
��T1 T2 ,����Ӧ�ġ�H 0�������������������������ͬ����
��P1 P2 , LΪ ������̡���Һ��������̬����
��2���ϳɰ���ԭ��Ϊ��N2(g)+3H2(g)  2NH3(g)
2NH3(g)  H��-92��4 kJ��mol���÷�Ӧ�������仯��ͼ��ʾ��
H��-92��4 kJ��mol���÷�Ӧ�������仯��ͼ��ʾ��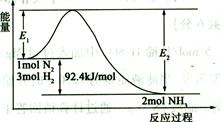
���ڷ�Ӧ��ϵ�м����������Ӧ��������E2�ı仯�� (���������С�����䡱)��������һ�ܱ������м���1molN2��3molH2����һ�������³�ַ�Ӧ���ų������� 92.4kJ.�����������������������
�۽�1 mol N2��3 mol H2�������������ܱ������У���һ�������´ﵽƽ�⣬��ʱ����߸�������H2��ת���ʣ����д�ʩ���е��� (����ĸ)��
| A���������а�ԭ�����ٳ���ԭ���� | B�����������ٳ���һ����H2 |
| C���ı䷴Ӧ�Ĵ��� | D��Һ�������������� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com