

·ÖĪö £Ø1£©ÓÉĶ¼æÉÖŖŅĒĘ÷µÄĆū³Ę£¬»īŠŌĢææɼÓæģ·“Ó¦ĖŁĀŹ£¬BÖŠæÉĄūÓĆ¼īŹÆ»ŅĪüŹÕ¹żĮæµÄĀČĘų”¢¶žŃõ»ÆĮņ£»“ÓŅĒĘ÷C£Ø·ÖŅŗĀ©¶·£©ÖŠ·Å³öŅŗĢ壬ŅŖ“ņæŖ»īČūŗĶČū×Ó£»
£Ø2£©¶”ÖŠÖʱøĀČĘų£¬ĄūÓĆŃĪĖįÓėĘÆ°×·Ū·“Ӧɜ³ÉĀČĘų£»ÓĆŃĒĮņĖįÄĘ¹ĢĢåŗĶÅØĮņĖįÖʱø¶žŃõ»ÆĮņĘųĢåŹ±£¬ČēŅŖæŲÖĘ·“Ó¦ĖŁ¶Č£¬ĄūÓĆ·ÖŅŗĀ©¶·æŲÖĘŅŗĢåµÄĮ÷ĖŁ£»
£Ø3£©ClSO3H¼ÓČČ·Ö½ā£¬Ņ²ÄÜÖʵĆĮņõ£ĀČÓėĮķĶāŅ»ÖÖĪļÖŹ£¬ÓÉŌ×ÓŹŲŗćæÉÖŖÉś³ÉĮņĖį£¬»ģŗĻĪļÖŠĪļÖŹµÄ·Šµć²»Ķ¬£»
£Ø4£©Č±ÉŁ×°ÖĆŅŅ£¬ĀČĘųŗĶ¶žŃõ»ÆĮņ·¢ÉśŃõ»Æ»¹Ō·“Ӧɜ³ÉĮņĖįŗĶŃĪĖį£»ĪŖĢįøß±¾ŹµŃéÖŠĮņõ£ĀČµÄ²śĀŹ£¬æŲÖĘĖŁĀŹ”¢ĪĀ¶ČµČĢįøߥūÓĆĀŹ£®
½ā“š ½ā£ŗ£Ø1£©ÓÉĶ¼æÉÖŖŅĒĘ÷AµÄĆū³ĘĪŖĄäÄż¹Ü»ņÉߊĪĄäÄż¹Ü£¬»īŠŌĢææɼÓæģ·“Ó¦ĖŁĀŹ£¬Ōņ»īŠŌĢæµÄ×÷ÓĆŹĒ“߻ƼĮ£»BÖŠæÉĄūÓĆ¼īŹÆ»ŅĪüŹÕ¹żĮæµÄĀČĘų”¢¶žŃõ»ÆĮņ£»ŅĒĘ÷C£Ø·ÖŅŗĀ©¶·£©£¬ŹµŃ鏱“ÓŅĒĘ÷CÖŠ·Å³öČÜŅŗµÄ²Ł×÷·½·ØŹĒ“ņæŖ·ÖŅŗĀ©¶·µÄ²£Į§Čū£Ø»ņĻČŹŌ²£Į§ČūµÄ°¼²ŪÓėĀ©¶·µÄ¾±ÉĻŠ”æ׶Ō×¼£©£¬ŌŁŠż×Ŗ»īČūŹ¹ŅŗĢåĮ÷ĻĀ£¬
¹Ź“š°øĪŖ£ŗĄäÄż¹Ü»ņÉߊĪĄäÄż¹Ü£»“߻ƼĮ£»¼īŹÆ»Ņ£»“ņæŖ·ÖŅŗĀ©¶·µÄ²£Į§Čū£Ø»ņĻČŹŌ²£Į§ČūµÄ°¼²ŪÓėĀ©¶·µÄ¾±ÉĻŠ”æ׶Ō×¼£©£¬ŌŁŠż×Ŗ»īČūŹ¹ŅŗĢåĮ÷ĻĀ£»
£Ø2£©¶”ÖŠÖʱøĀČĘų£¬ĄūÓĆŃĪĖįÓėĘÆ°×·Ū·“Ӧɜ³ÉĀČĘų£¬·¢ÉśĄė×Ó·“Ó¦ĪŖCl-+ClO-+2H+=Cl2”ü+H20£»ÓĆŃĒĮņĖįÄĘ¹ĢĢåŗĶÅØĮņĖįÖʱø¶žŃõ»ÆĮņĘųĢåŹ±£¬ČēŅŖæŲÖĘ·“Ó¦ĖŁ¶Č£¬ĄūÓĆ·ÖŅŗĀ©¶·æŲÖĘŅŗĢåµÄĮ÷ĖŁ£¬Ö»ÓŠa·ūŗĻ£¬
¹Ź“š°øĪŖ£ŗCl-+ClO-+2H+=Cl2”ü+H20£»a£»
£Ø3£©ClSO3H¼ÓČČ·Ö½ā£¬Ņ²ÄÜÖʵĆĮņõ£ĀČÓėĮķĶāŅ»ÖÖĪļÖŹ£¬ÓÉŌ×ÓŹŲŗćæÉÖŖÉś³ÉĮņĖį£¬·“Ó¦ĪŖ2ClSO3H$\frac{\underline{\;\;”÷\;\;}}{\;}$SO2Cl2+H2SO4£¬»ģŗĻĪļÖŠĪļÖŹµÄ·Šµć²»Ķ¬£¬Ōņ·ÖĄė²śĪļµÄ·½·ØĪŖÕōĮó£¬
¹Ź“š°øĪŖ£ŗ2ClSO3H$\frac{\underline{\;\;”÷\;\;}}{\;}$SO2Cl2+H2SO4£»ÕōĮó£»
£Ø4£©Č±ÉŁ×°ÖĆŅŅ£¬ĀČĘųŗĶ¶žŃõ»ÆĮņ·¢ÉśŃõ»Æ»¹Ō·“Ӧɜ³ÉĮņĖįŗĶŃĪĖį£¬·“Ó¦ĪŖSO2+Cl2+2H20=H2SO4+2HCl£»ĪŖĢįøß±¾ŹµŃéÖŠĮņõ£ĀČµÄ²śĀŹ£¬ŌŚŹµŃé²Ł×÷ÖŠ»¹ŠčŅŖ×¢ŅāµÄŹĀĻīÓŠæŲÖĘĘųĮ÷ĖŁĀŹ£¬ŅĖĀż²»ŅĖæģ£Ø»ņČōČż¾±ÉÕĘæ·¢ĢĢ£¬æÉŹŹµ±½µĪĀ£»»ņĻČĶØĄäÄżĖ®£¬ĄäÄż»ŲĮ÷ø±²śĪļŗĶ²śĘ·£¬ŌŁ½ųŠŠŹµŃ飩£¬
¹Ź“š°øĪŖ£ŗSO2+Cl2+2H20=H2SO4+2HCl£»æŲÖĘĘųĮ÷ĖŁĀŹ£¬ŅĖĀż²»ŅĖæģ£®
µćĘĄ ±¾Ģāæ¼²éÖʱøŹµŃé·½°øµÄÉč¼Ę£¬ĪŖøßĘµæ¼µć£¬°ŃĪÕÖʱøŌĄķ”¢ŹµŃé×°ÖƵÄ×÷ÓĆ”¢ŹµŃé¼¼ÄÜĪŖ½ā“šµÄ¹Ų¼ü£¬²ąÖŲ·ÖĪöÓėŹµŃéÄÜĮ¦µÄ漲飬ĢāÄæÄŃ¶Č²»“ó£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 2.0mol/L | B£® | 0.24mol/L | C£® | 0.19 mol/L | D£® | 3 mol/L |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® |  ³ĘĮæ | B£® | 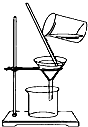 ×ŖŅĘ | ||
| C£® |  ¹żĀĖ | D£® |  ÕōĮó |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
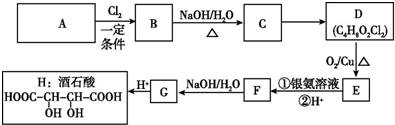
 +Cl3$\stackrel{Ņ»¶ØĢõ¼ž}{”ś}$
+Cl3$\stackrel{Ņ»¶ØĢõ¼ž}{”ś}$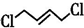
 £»
£»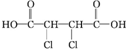 +4NaOH$\stackrel{”÷}{”ś}$
+4NaOH$\stackrel{”÷}{”ś}$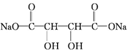 +2NaCl+2H2O£»
+2NaCl+2H2O£»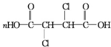 +n
+n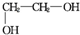 $\stackrel{Ņ»¶ØĢõ¼ž}{”ś}$
$\stackrel{Ņ»¶ØĢõ¼ž}{”ś}$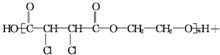
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ŌŚBa£ØOH£©2ČÜŅŗÖŠ£¬c£ØBa2+£©=2c£ØOH-£© | |
| B£® | ÕįĢĒ”¢µķ·Ū”¢ÓĶÖ¬¼°ĘäĖ®½ā²śĪļ¾łĪŖ·Ēµē½āÖŹ | |
| C£® | ŌŚÄŃČܵē½āÖŹµÄ±„ŗĶČÜŅŗÖŠ£¬µē½āÖŹµÄKspŌ½Š”£¬ĘäĪļÖŹµÄĮæÅضČŌ½Š” | |
| D£® | ·“Ó¦5S2O82-+2Mn2++8H20ØT10SO42-+2MnO4-+16H+£¬µĆµē×ÓµÄŌŖĖŲŹĒŃõŌŖĖŲ£¬·“Ó¦ÖŠ×ŖŅĘ10e- |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 2.2mol | B£® | 1.2mol | C£® | 0.6mol | D£® | 1.0mol |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
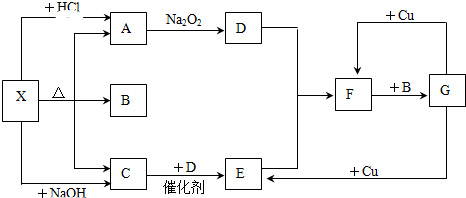
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
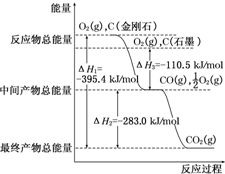
| A£® | CO£Øg£©+$\frac{1}{2}$O2£Øg£©ØTCO2£Øg£©”÷H=-282.6 kJ•mol”„1 | |
| B£® | 2mol CO£Øg£©Óė1mol O2£Øg£©·“Ӧɜ³É2mol CO2£Øs£©·Å³öČČĮæŠ”ÓŚ565.2 kJ | |
| C£® | ĻąĶ¬Ģõ¼žĻĀ£¬2mol CO£Øg£©ŗĶ1mol O2£Øg£©µÄ×ÜÄÜĮæ“óÓŚ2mol CO2£Øg£©µÄ×ÜÄÜĮæ | |
| D£® | ²šæŖ2mol COŗĶ1mol O2µÄ»Æѧ¼üĖłŠč×ÜÄÜĮæµĶÓŚŠĪ³É2mol CO2»Æѧ¼üĖł·Å³ö×ÜÄÜĮæ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 £Ø1£©¼ŅÓĆŅŗ»ÆĘųÖŠÖ÷ŅŖ³É·ÖÖ®Ņ»ŹĒ¶”Ķé£ØC4H10£©£®µ±1g¶”ĶéĶźČ«Č¼ÉÕ²¢Éś³ÉCO2ŗĶŅŗĢ¬Ė®Ź±£¬·Å³öČČĮæ50kJ£®ŹŌŠ“³ö¶”ĶéČ¼ÉÕ·“Ó¦µÄČČ»Æѧ·½³ĢŹ½
£Ø1£©¼ŅÓĆŅŗ»ÆĘųÖŠÖ÷ŅŖ³É·ÖÖ®Ņ»ŹĒ¶”Ķé£ØC4H10£©£®µ±1g¶”ĶéĶźČ«Č¼ÉÕ²¢Éś³ÉCO2ŗĶŅŗĢ¬Ė®Ź±£¬·Å³öČČĮæ50kJ£®ŹŌŠ“³ö¶”ĶéČ¼ÉÕ·“Ó¦µÄČČ»Æѧ·½³ĢŹ½²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com