

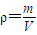 计算;
计算; +6×
+6× +12×
+12× +1=8,
+1=8, g,
g, =
= g/cm3,
g/cm3,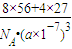 ;
; =0.12mol
=0.12mol =1.2mol/L.
=1.2mol/L.

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:阅读理解
(12分)晶体的最小重复单位是晶胞,晶胞一般为平行六面体。NaCl属立方面心晶格,在NaCl晶胞中8个顶点各有一个Na+,6个面心处各有一个Na+,故我们说Na+形成立方面心晶格,而在该晶胞的12条棱的中点处各有一个Cl-,在该立方晶胞的体心处还有一个Cl-,故Cl-也形成立方面心晶格。
1.KCl和NaCl的晶格型式相同。已知Na+离子的半径是Cl-离子的0.5倍,而又是K+离子的0.7倍,计算:KCl晶胞和NaCl晶胞的边长之比;KCl和NaCl晶体的密度之比。
2.将NaCl晶胞中的所有Cl-去掉,并将Na+全部换成C原子,再在每两个不共面的“小立方体”中心处各放置一个C原子便构成了金刚石的一个晶胞,则一个金刚石的晶胞中有_______个C原子。并计算金刚石的密度。(已知C原子的半径为7.7×10-11m)
3.白硅石SiO2属AB2型共价键晶体。若将金刚石晶胞中的所有C原子换成Si原子,同时在每两个相邻的Si原子(距离最近的两个Si原子)中心联线的中点处增添一个O原子,则构成SiO2晶胞,故SiO2晶胞中有____个Si原子,____个O原子,离O原子最近的Si原子有____个,离Si原子最近的O原子有____个。
4.干冰(固态CO2)属于分子晶体。若把每个CO2分子抽象为一个质点(微粒),则其晶胞也属于立方面心晶格,故一个干冰晶胞中有_____个CO2,与1个CO2分子最近的CO2分子有_____个;在干冰分子中,原子之间靠______结合,CO2分子之间靠______结合。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com