
| A、NaOH | B、SiO2 | C、Fe | D、C2H4 |


 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案科目:高中化学 来源: 题型:
 始祖鸟烯(Pterodactyladiene)形状宛如一只展翅飞翔的鸟,其键线式结构表示如图,其中R1、R2为烷烃基.则下列有关始祖鸟烯的说法中正确的是( )
始祖鸟烯(Pterodactyladiene)形状宛如一只展翅飞翔的鸟,其键线式结构表示如图,其中R1、R2为烷烃基.则下列有关始祖鸟烯的说法中正确的是( )查看答案和解析>>
科目:高中化学 来源: 题型:
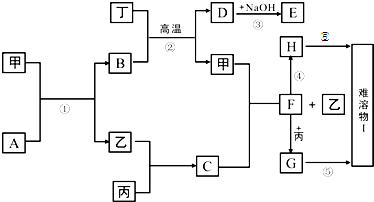
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 (1)SO2的排放是造成酸雨的主要因素.某地区酸雨pH随时间的变化如右图所示.请用化学方程式表示该地区酸雨pH随时间增加而减小的原因
(1)SO2的排放是造成酸雨的主要因素.某地区酸雨pH随时间的变化如右图所示.请用化学方程式表示该地区酸雨pH随时间增加而减小的原因| 1 |
| x |
| 1 |
| x |
| 3 |
| x |


查看答案和解析>>
科目:高中化学 来源:2011届黑龙江省大庆实验中学高三上学期期末考试化学试卷 题型:填空题
(12分)短周期元素形成的纯净物A、B、C、D、E是转化关系如下图所示,物质A与物质B之间的反应不在溶液中进行(E可能与A、B两种物质中的某种相同)。
请回答下列问题:
(1)若C是离子化合物,D是一种强碱,写出C的一种化学式 。
(2)若E的水溶液呈现弱酸性,D是既能溶于强酸、又能溶于强碱的化合物。
①用电离方程式解释D既能溶于强酸,又能溶于强碱的原因。
。
②用等式表示E与NaOH溶液反应后生成正盐的溶液中所有离子浓度之间的关系
。
(3)若C是一种气体,D是一种强酸,则:
①C与水反应的化学方程式为 。
②有人认为“浓H2SO4可以干燥气体C”。某同学为了验证该观点是否正确,用下图装置进行实验。实验过程中,浓H2SO4中未发现有气体逸出,且变为红棕色,则你得出的结论是 。
③已知常温下物质A与物质B生成1mol气体C的△H为-57.07kJ·mol-1,1 mol气体C与H2O反应生成D溶液和E气体的△H为-46kJ ·mol-1,写出物质A与物质B及水生成D溶液的热化学方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com