
| A. | 在有AgCl沉淀的溶液中加入NaC1固体,c(Ag+)减小 | |
| B. | 室温下100mL pH=1.3的Ba(OH)2溶液中OH-的物质的量为0.02 mol | |
| C. | 稀释0.1 mol/L的NH3•H2O溶液,溶液中所有离子浓度均减小 | |
| D. | 溶液中水电离出c(H+)和水电离出的c(OH-)的乘积一定等于10-14 |
分析 A.在有AgCl沉淀的溶液中加入NaC1固体,氯离子浓度增大,Ksp不变;
B.根据pH=-lgc(H+)计算;
C.稀释0.1 mol/L的NH3•H2O溶液,c(OH-)减小,Kw不变;
D.如为酸、碱溶液,抑制水的电离,则溶液中水电离出c(H+)和水电离出的c(OH-)的乘积减小.
解答 解:A.在有AgCl沉淀的溶液中加入NaC1固体,氯离子浓度增大,Ksp=c(Cl-)c(Ag+)不变,则c(Ag+)减小,故A正确;
B.pH=-lg(H+)=1.3,则c(H+)=0.05mol/L,OH-的物质的量为0.005 mol,故B错误;
C.稀释0.1 mol/L的NH3•H2O溶液,c(OH-)减小,Kw不变,则c(H+)增大,故C错误;
D.如为酸、碱溶液,抑制水的电离,则溶液中水电离出c(H+)和水电离出的c(OH-)的乘积减小,应小于10-14,故D错误.
故选A.
点评 本题综合考查弱电解质以及难溶电解质的溶解平衡,为高频考点,侧重于学生的分析能力的考查,注意把握电解质的电离特点以及影响因素,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 用加热、蒸发的方法除去粗盐中的CaCl2、MgCl2等杂质 | |
| B. | 用过滤的方法除去NaCl溶液中含有的少量淀粉胶体 | |
| C. | 用溶解、过滤的方法提纯含有少量BaSO4的BaCO3 | |
| D. | 用丁达尔现象区分溶液与胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
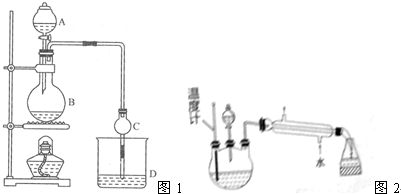
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
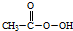 (过氧乙酸)+H2O
(过氧乙酸)+H2O查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现使用酸碱中和滴定法测定市售白醋的总酸量(g•100mL-1).
现使用酸碱中和滴定法测定市售白醋的总酸量(g•100mL-1).| 滴定次数实验数据(mL) | 1 | 2 | 3 | 4 |
| V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
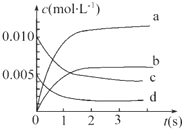
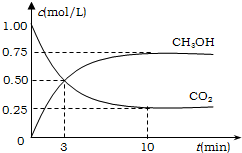 工业上有一种方法有效地开发利用CO2,是用CO2来生产燃料甲醇.为探究反应原理,进行如下实验,在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示.
工业上有一种方法有效地开发利用CO2,是用CO2来生产燃料甲醇.为探究反应原理,进行如下实验,在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
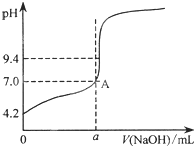 现用邻苯二甲酸氢钾标准溶液来测定NaOH溶液的浓度.用氢氧化钠溶液来滴定邻苯二甲酸溶液时有下列操作:
现用邻苯二甲酸氢钾标准溶液来测定NaOH溶液的浓度.用氢氧化钠溶液来滴定邻苯二甲酸溶液时有下列操作:| 滴定次数 实验数据 | 1 | 2 | 3 | 4 |
| V(样品)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)/mL(初读数) | 0.10 | 0.30 | 0.00 | 0.20 |
| V(NaOH)/mL(终读数) | 20.08 | 20.30 | 20.80 | 20.22 |
| V(NaOH)/mL(消耗) | 19.98 | 20.00 | 20.80 | 20.02 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在2L密闭容器内,800℃时反应2NO(g)+O2(g)═2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应2NO(g)+O2(g)═2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com