
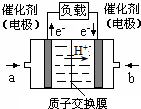
 可给笔记本电脑供电的甲醇燃料电池已经面世,其结构示意图如下.甲醇在催化剂作用下提供质子(H+)和电子.电子经外电路、质子经内电路到达另一极与氧气反应.该电池总反应式为:2CH3OH+3O2═2CO2+4H2O.下列说法中正确的是( )
可给笔记本电脑供电的甲醇燃料电池已经面世,其结构示意图如下.甲醇在催化剂作用下提供质子(H+)和电子.电子经外电路、质子经内电路到达另一极与氧气反应.该电池总反应式为:2CH3OH+3O2═2CO2+4H2O.下列说法中正确的是( )| A. | 右边的电极为电池的负极,b处通入的是空气 | |
| B. | 左边的电极为电池的负极,a处通入的是甲醇 | |
| C. | 电池负极的反应式为:CH3OH+H2O═CO2+6H++4e- | |
| D. | 电池正极的反应式为:O2+2H2O+4e-═4OH- |
分析 原电池放电时,电子从负极沿导线流向正极,燃料电池中,通入燃料的电极是负极、通入氧化剂的电极是正极,根据电子流向知,左边电极是负极、右边电极是正极,a处通入的是甲醇、b处通入的是空气,电解质溶液呈酸性,负极反应式为CH3OH+H2O-6e-=CO2+6H+,正极反应式为O2+4H++4e-=2H2O,据此分析解答.
解答 解:A.燃料电池中,通入燃料甲醇的电极是负极、通入氧化剂氧气的电极是正极,根据电子流向知,右边电极是正极,故A错误;
B.根据电子流向知,左边电极是负极,负极上甲醇失电子发生氧化反应,所以a处通入的是甲醇,故B正确;
C.负极上甲醇失电子发生氧化反应,电极反应式为CH3OH+H2O-6e-=CO2+6H+,故C错误;
D.正极上氧气得电子发生还原反应,电极反应式为O2+4H++4e-=2H2O,故D错误;
故选B.
点评 本题考查化学电源新型电池,为高频考点,所有的燃料电池中通入燃料的电极都是负极、通入氧化剂的电极是正极,难点是电极反应式的书写,要结合电解质溶液酸碱性书写.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:选择题
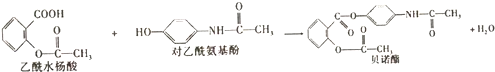
| A. | 根据有机物的分类,乙酰水杨酸也属于芳香烃 | |
| B. | 可用FeCl3溶液区别乙酰水杨酸和对乙酰氨基酚 | |
| C. | 乙酰水杨酸和对乙酰氨基酚均能与NaHCO3溶液反应 | |
| D. | 1mol乙酰水杨酸最多能与2molNaOH发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 近期媒体报道的某白酒中添加的塑化剂是对人体健康无害的物质 | |
| B. | 尽量使用含12C的产品,减少使用含13C或14C的产品符合“低碳经济”宗旨 | |
| C. | 大量二氧化碳气体的排放是形成酸雨的主要原因 | |
| D. | 使用太阳能、风能、潮汐能等能源能减少PM2.5的污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2在正极发生氧化反应 | |
| B. | 燃料电池属二次电池 | |
| C. | 燃料电池的能量转化率常达100% | |
| D. | 供电时产生无污染的水,属于环境友好电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. CH3COOC2H5+H2O,该反应类型是酯化(取代)反应.
CH3COOC2H5+H2O,该反应类型是酯化(取代)反应. 2CH3CHO+2H2O.
2CH3CHO+2H2O.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应产物的总焓与反应物的总焓之差,称为反应焓变 | |
| B. | 反应产物的总焓小于反应物的总焓,该反应为吸热反应 | |
| C. | 同一反应在不同温度下进行,其焓变是不同的 | |
| D. | 已知2NO2(g)═N2O4(g)△H1,N2O4(g)═2NO2(g)△H2,则△H1=-△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,20 g D2O和足量的金属钠反应产生气体的分子数为0.5NA | |
| B. | 1 mol Na2O2与足量的水反应,转移的电子数为2NA | |
| C. | NA 个SO3分子在标准状况下的体积为22.4 L | |
| D. | 25℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH-数目为0.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com