

| 选项 | X | Y | Z | M |
| A | O2 | CO2 | CO | C |
| B | CH3CH2OH | CH3CHO | CH3COOH | O2 |
| C | NaOH | NaHCO3 | Na2CO3 | CO2 |
| D | NH3 | NO | NO2 | O2 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.O2$\stackrel{C}{→}$CO2$\stackrel{C}{→}$CO
B.CH3CH2OH$\stackrel{O_{2}}{→}$CH3CHO$\stackrel{O_{2}}{→}$CH3COOH;
C.NaOH$\stackrel{过量CO_{2}}{→}$NaHCO3;NaHCO3和CO2不能反应生成碳酸钠;
D.NH3$\stackrel{O_{2}}{→}$NO$\stackrel{O_{2}}{→}$NO2.
解答 解:A.O2$\stackrel{C}{→}$CO2$\stackrel{C}{→}$CO,C+O2=CO2,CO2+C=2CO,可以实现上述转化,故A不选;
B.2CH3CH2OH+O2→2CH3CHO+2H2O;2CH3CHO+O2→2CH3COOH,可以实现上述转化,故B不选;
C.NaOH$\stackrel{过量CO_{2}}{→}$NaHCO3;NaHCO3和CO2不能反应生成碳酸钠,不能实现上述转化,故C选;
D.NH3$\stackrel{O_{2}}{→}$NO$\stackrel{O_{2}}{→}$NO2,4NH3+5O2=4NO+6H2O,2NO+O2=2NO2,可以实现上述转化,故D不选;
故选C.
点评 本题考查无机物的推断,注意转化中发生的化学反应是解答本题的关键,硝酸的强氧化性、氨气的催化氧化、和量不同产物不同的判断为解答的易错点,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:实验题

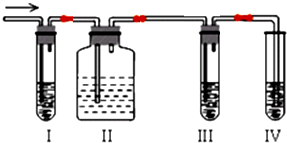
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等质量的H2S和PH3含有相同的原子数 | |
| B. | NH3的摩尔质量为17 | |
| C. | 9.03×1023个CO2分子的质量为66g | |
| D. | 同温同压下,相同体积的物质,其物质的量一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
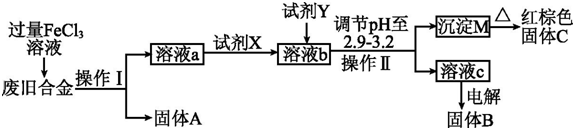
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烧杯中一定有铜,可能有铁 | |
| B. | 烧杯中铁铜都有 | |
| C. | 溶液中一定有Fe2+,可能有Cu2+、Fe3+ | |
| D. | 烧杯中有铁无铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4molA+2molB | B. | 1.5molC+0.5molD | ||
| C. | 1molB+1molD | D. | 1molA+0.5molB+1.5molC+0.5molD |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
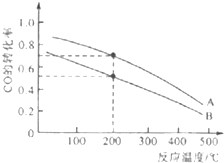 钢铁工业是国民经济的重要基础产业,是国家经济水平和综合国力的重要标志,高炉炼铁是最为普遍的一种炼铁方法.
钢铁工业是国民经济的重要基础产业,是国家经济水平和综合国力的重要标志,高炉炼铁是最为普遍的一种炼铁方法.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
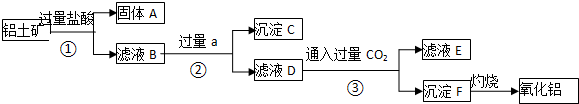
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com