
| A. | 微粒半径由小到大的顺序是S2-、Na+、Mg2+ | |
| B. | 杂化轨道可用于形成σ键和π键 | |
| C. | Cu(NH3)4]2+中H提供接受孤对电子的空轨道 | |
| D. | 分子中心原子通过sp3杂化轨道成键时,该分子不一定为四面体构型 |
分析 A.电子层数越多离子半径越大,电子层数相同核电荷数越大离子半径越小;
B.杂化轨道用来形成σ键或容纳孤对电子,未杂化的轨道与杂化轨道所在平面垂直,可用来形成π键;
C.在配合物离子中,中心原子或离子提供空轨道,配体提供孤电子对;
D.分子中心原子通过sp3杂化轨道成键时,若中心原子存在孤电子对时,该分子就不是正四面体结构.
解答 解:A.离子的电子层数越多离子半径越大,电子层数相同时离子的核电荷数越大离子半径越小,则离子半径由小到大的顺序是:Mg2+<Na+<S2-,故A错误;
B.杂化轨道只用于形成σ键或用于容纳未参与成键的孤对电子,没有杂化的P轨道形成π键,故B正确;
C.在配合物[Cu(NH3)4]2+中,铜离子提供空轨道,氮原子提供孤电子对,配位键为: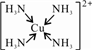 ,故提供空轨道接受孤对电子的微粒是Cu2+,故C错误;
,故提供空轨道接受孤对电子的微粒是Cu2+,故C错误;
D.分子中中心原子通过sp3杂化轨道成键时,说明中心原子的价层电子对数为4,若中心原子存在孤电子对,该分子就不是正四面体,可能是三角锥形或V形,如NH3是三角锥形、H2O是V形,故D正确;
故选C.
点评 本题考查了配合物的成键情况判断、原子轨道杂化方式及杂化类型的应用、离子半径大小半径等知识,题目难度中等,明确配合物的成键情况、原子轨道杂化方式为解答关键,注意掌握判断离子半径大小半径的方法,试题培养了学生的灵活应用能力.


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:选择题
| A. | Na+、HCO3-、SO42-、H+ | B. | K+、AlO22-、H+、Cl- | ||
| C. | Fe2+、H+、Cl-、NO3- | D. | Al3+、H+、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气的水溶液能导电,所以氯气是电解质 | |
| B. | 干燥的氯气无漂白性,液氯具有极强的漂白性 | |
| C. | 氯气能使紫色石蕊溶液先变红后褪色 | |
| D. | 铜在氯气中燃烧生成红棕色烟 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气通入水中:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 盐酸滴入澄清石灰水中:Ca(OH)2+2H+═Ca2++2H2O | |
| C. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-═BaSO4↓ | |
| D. | 铜与硝酸银溶液反应:Cu+2Ag+═Cu2++2Ag |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验及现象 | 结论 |
| A | 将湿润的红色石蕊试纸放在试管口,试纸变蓝 | 反应中有NH3产生 |
| B | 收集产生的气体并点燃,火焰呈淡蓝色 | 反应中有H2产生 |
| C | 收集气体的同时测得溶液的pH为8.0 | 弱碱性溶液中Mg也可被氧化 |
| D | 将光亮的镁条放入pH为8.6的NaHCO3溶液中,有气泡产生 | 弱碱性溶液中OH-氧化了Mg |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
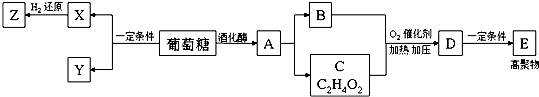
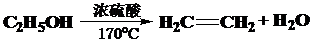 .
.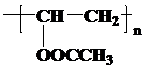 .
.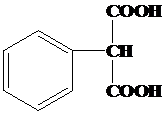 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只要不加入其他物质,液氨中c(NH4+ )总是等于c(NH2- ) | |
| B. | 一定温度下,c(NH4+ )×c(NH2- )为常数 | |
| C. | 其他条件不变,增加液氨的量,电离平衡正向移动 | |
| D. | 维持温度不变,向液氨中加入少量氯化铵固体,c(NH2-)将减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
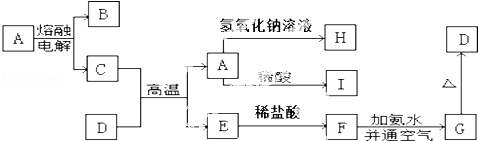
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com