
已知有关热化学方程式为:①4NH3(g)+5O2(g) 4NO(g)+6H2O(g)△H=-905kJ/mol;②3H2(g)+N2(g)
4NO(g)+6H2O(g)△H=-905kJ/mol;②3H2(g)+N2(g) 2NH3(g)△H=-92.4kJ/mol;③2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol;④N2(g)+O2(g)=2NO(g)△H=QkJ/mol;反应①中有关化学键的键能(kJ/mol)如下:H—O:463,H—N:391,O=O:497
2NH3(g)△H=-92.4kJ/mol;③2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol;④N2(g)+O2(g)=2NO(g)△H=QkJ/mol;反应①中有关化学键的键能(kJ/mol)如下:H—O:463,H—N:391,O=O:497
(1)①Q=___________。
②NO中的化学键键能为_________kJ/mol。
(2)向某密闭容器中充入amolNH3、bmolO2后,测得反应体系中某种量值X与压强P、温度T之间的变化如图1所示,图2表示温度为T2时,当容器为1L恒容密闭容器时,容器中NH3的平衡转化率与反应开始时两种反应物的投料之比(用M表示)的关系。
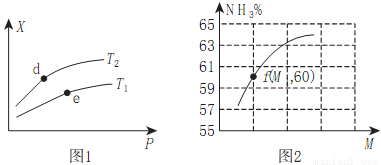
①若X表示NH3的百分含量,则T2_____T1(填>、<、无法确定);d、e两点的正反应的平衡常数K(d)_____K(e)。
②X还可以表示_____________。
A.混合气体的平均摩尔质量B.NO的产率C.△H值
③M=__________(用含a、b的式子表示,后同),若M1=1.25,则此时O2的转化率为__________%。
(3)有科学家电解原理获得高产率的合成氨,则阴极上的电极反应式为(已知电解质能传递H+)_______________。
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源:2015-2016学年江西省高二下期中化学试卷(解析版) 题型:填空题
根据以下有关信息确定有机物的组成
(1)相对分子质量为72且沸点最低的烷烃的名称为 ;
(2)C4H9Cl的核磁共振氢谱表明其只有一种化学环境的氢,则A的结构简式为 。
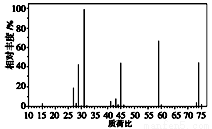
(3)下图是某有机物的质谱图,则其相对分子质量为 ,若该有机物含有一个氧原子,其分子式为 。
(4)已知 : 如果要合成
如果要合成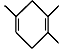 ,所用的起始原料的结构简式为
,所用的起始原料的结构简式为
。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高二下期中化学试卷(解析版) 题型:选择题
下列过程需要通电后才能进行的是
① 电离 ② 电解 ③ 电镀 ④ 电化学腐蚀
A.①②③ B.②③ C.②④ D.全部
查看答案和解析>>
科目:高中化学 来源:2016届海南省高三高考考前模拟十二化学试卷(解析版) 题型:选择题
N2的结构可以表示为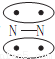 ,CO的结构可以表示为
,CO的结构可以表示为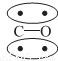 ,其中椭圆框表示π键,下列说法中不正确的是( )
,其中椭圆框表示π键,下列说法中不正确的是( )
A.N2分子与CO分子中都含有叁键
B.CO分子中有一个π键是配位键
C.N2、CO分别由非极性键和极性键结合,因此二者不是等电子体
D.N2与CO的化学性质相同
查看答案和解析>>
科目:高中化学 来源:2016届海南省高三高考考前模拟十二化学试卷(解析版) 题型:选择题
一种熔融碳酸盐燃料电池原理示意如图,下列有关该电池的说法正确的是( )
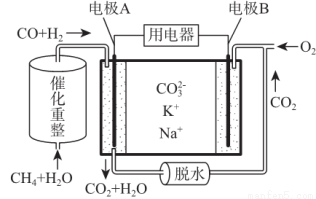
A.反应CH4+H2O 3H2+CO,每消耗1molCH4转移6mol电子
3H2+CO,每消耗1molCH4转移6mol电子
B.电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O
C.电池工作时,CO32-向电极B移动
D.电极B上发生的电极反应为:O2+2CO2+4e-=2CO32-
查看答案和解析>>
科目:高中化学 来源:2016届海南省高三高考考前模拟十二化学试卷(解析版) 题型:选择题
下列说法不正确的是( )
A.浓硝酸与足量铜片反应时,先生成红棕色气体,后生成无色气体
B.浓硫酸具有强氧化性,常温下可将铁、铝的单质氧化
C.饱和氯水既有酸性又有漂白性,加入NaHCO3后漂白性减弱
D.浓盐酸与足量二氧化锰反应后,盐酸有剩余
查看答案和解析>>
科目:高中化学 来源:2016届福建省高三下学期周考五理科综合化学试卷(解析版) 题型:填空题
研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)CO可用于炼铁,已知:
Fe2O3(s)+3C(s)═2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1,
C(s)+CO2(g)═2CO(g)△H2=+172.5kJ•mol-1
则CO还原Fe2O3(s)的热化学方程式为__________。
(2)分离高炉煤气得到的CO与空气可设计成燃料电池(以KOH溶液为电解液)。写出该电池的负极反应式:__________。
(3)CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g) 测得CH3OH的物质的量随时间的变化见图1。
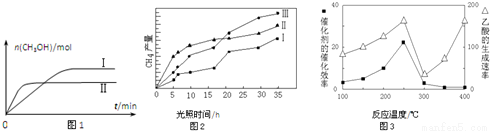
①曲线I、Ⅱ对应的平衡常数大小关系为KⅠ__________KⅡ(填“>”或“=”或“<”).
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
容 器 | 甲 | 乙 |
反应物投入量 | 1molCO2、3molH2 | a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为__________。
(4)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2.紫外光照射时,在不同催化剂(I、II、III)作用下,CH4产量随光照时间的变化见图2.在0~15小时内,CH4的平均生成速率I、II和III从大到小的顺序为__________(填序号).
(5)以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系见图3。
①乙酸的生成速率主要取决于温度影响的范围是__________。
②Cu2Al2O4可溶于稀硝酸,写出有关的离子方程式:__________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁鞍山一中高二下期中化学试卷(解析版) 题型:选择题
正硼酸(H3BO3)是一种层状结构的白色晶体,层内的H3BO3分子通过氢键相连(如下图),下列有关说法正确的是( )
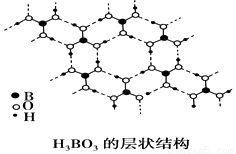
A.正硼酸晶体属于原子晶体
B.H3BO3分子的稳定性与氢键有关
C.分子中硼原子最外层满足8电子稳定结构
D.1 mol H3BO3晶体中有3 mol氢键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com