
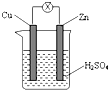
 如图所示,把锌片和铜片用导线相连后插入稀硫酸溶液中构成原电池.下列叙述正确的是( )
如图所示,把锌片和铜片用导线相连后插入稀硫酸溶液中构成原电池.下列叙述正确的是( ) 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源: 题型:阅读理解
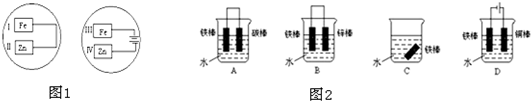
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2011-2012年浙江余姚中学高一下学期第一次质量检测化学实验班试卷(解析版) 题型:填空题
I:(1)氢气被人们看作理想的绿色能源,己知氢气的热值是143kJ·g-1。请写出氢气燃烧的热化学方程式 。
(2)1molN2(g)和1molO2(g)在一定条件下反应生成2molNO(g),吸收180kJ的热量,已知断裂1molN2(g)中的N≡N和1molO2(g)中的O=O分别需要吸收946kJ和498kJ的能量,则1molNO分子中的化学键形成时可释放_______kJ的能量。
Ⅱ:在一个U形管里盛有氯化铜溶液,并插入两块锌片作电极,如图所示: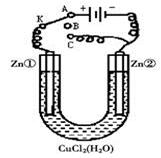
(1)如果把电键K接A,这一装置形成 装置,Zn①极是_____极,其电极反应式是_______________________。
(2)上述反应进行5min后,转换电键K到C,这一装置形成________装置,Zn②极是_______极,其电极反应式是____________________;
(3)上述装置进行2min后,再转换电键K到B,在Zn②极上发生的腐蚀属于 ,Zn①极发生的腐蚀主要属于 。
查看答案和解析>>
科目:高中化学 来源:浙江省模拟题 题型:填空题
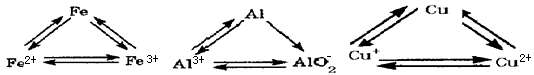
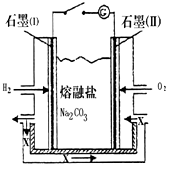



查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com