
【题目】砷(As)是第四周期第V A族元素,用化学用语回答问题:
(1)砷的最高价氧化物对应的水化物化学式是 _________,气态氢化物的稳定性ASH3________(填写“大于”或“小于”)NH3。
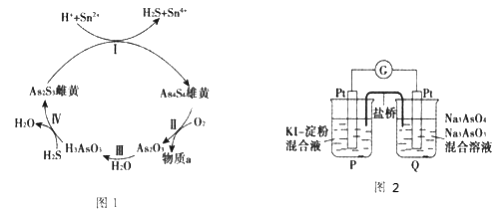
(2)砷在自然界中主要以硫化物形式(如雄黄As4S4、雌黄As2S3等)存在。雄黄和雌黄的转换关系如图1所示:
①气体物质a是 _____________(填化学式)。
②第I步反应的离子方程式是_________________________________。
(3)Na2HAsO3溶液呈碱性,原因是_______________(用离子方程式表示),该溶液中c(H2AsO3-)______ c(AsO33-) (填“>”、“<”或“=”)。
(4)某原电池装置如图2所示,电池总反应为AsO43-++2I-+H2O![]() AsO33-+I2+ 2OH-。当P池中溶液由无色变蓝色时,正极上的电极反应式为_________;当电流计指针归中后向Q中加入一定量的NaOH,电流计指针反向偏转,此时P中的反应式是__________________。
AsO33-+I2+ 2OH-。当P池中溶液由无色变蓝色时,正极上的电极反应式为_________;当电流计指针归中后向Q中加入一定量的NaOH,电流计指针反向偏转,此时P中的反应式是__________________。
【答案】 H3AsO4 小于 SO2 2As2S3+4H++2Sn2+=2H2S+2Sn4++As4S4 HAsO32-+H2O![]() H2AsO3-+OH- > AsO43-+2e- +H2O= AsO33-+2OH- I2 + 2e- =2I-
H2AsO3-+OH- > AsO43-+2e- +H2O= AsO33-+2OH- I2 + 2e- =2I-
【解析】 (1) 砷(As)是第四周期第V A族元素,砷的最高价氧化物对应的水化物化学式为H3AsO4,同一主族,从上到下,元素的非金属性逐渐减弱,气态氢化物的稳定性逐渐减弱,稳定性ASH3小于NH3,故答案为:H3AsO4;小于;
(2) ①Ⅱ中,As4S4反应后生成As2O3,根据化合价升降守恒,硫元素的化合价需要升高,因此气体物质a为二氧化硫,故答案为: SO2;
②Ⅰ中Sn的化合价升高,As的化合价降低,所以As2S3在反应中得电子作氧化剂,反应的离子方程式为2As2S3+4H++2Sn2+=2H2S+2Sn4++As4S4,故答案为:2As2S3+4H++2Sn2+=2H2S+2Sn4++As4S4;
(3) Na2HAsO3溶液呈碱性,是因为Na2HAsO3属于强碱弱酸盐,存在HAsO32-+H2O![]() H2AsO3-+OH-,Na2HAsO3溶液呈碱性,说明水解程度大于电离沉淀,因此溶液中c(H2AsO3-)>c(AsO33-) ,故答案为:HAsO32-+H2O
H2AsO3-+OH-,Na2HAsO3溶液呈碱性,说明水解程度大于电离沉淀,因此溶液中c(H2AsO3-)>c(AsO33-) ,故答案为:HAsO32-+H2O![]() H2AsO3-+OH-;>;
H2AsO3-+OH-;>;
(4) P池中溶液由无色变成蓝色,说明P池Pt极为负极,则Q池中Pt极为正极.发生的电极反应为AsO43-+H2O+2e-=AsO33-+2OH-,平衡后,加入NaOH溶液,反应逆向进行,此时Q池中Pt极为负极, P中Pt极为正极,发生还原反应,反应式为I2 + 2e- =2I-,故答案为:AsO43-+H2O+2e-=AsO33-+2OH-;I2 + 2e- =2I-。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】已知2H2(g)+O2(g)=2H2O(l) ΔH=-569.6kJ/mol,2H2O(g)=2H2(g)+O2(g) ΔH=+482.1 kJ/mol。现有1g液态H2O,蒸发时吸收的热量是 ( )
A. 2.43 kJ B. 4.86 kJ C. 43.8 kJ D. 87.5 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】容积固定为3 L的某密闭容器中加入1 mol A、2 mol B,一定温度下发生如下反应:A(s)+2B(g)![]() C(g)+D(g),经反应5 min后,测得C的浓度为0.3 mol·L-1。则下列说法中正确的是
C(g)+D(g),经反应5 min后,测得C的浓度为0.3 mol·L-1。则下列说法中正确的是
A. 5 min内D的平均反应速率为0.02 mol·L-1·min-1
B. 5 min内A的平均反应速率为0.06 mol·L-1·min-1
C. 经5 min后,向容器内再加入C,正反应速率变小
D. 平衡状态时,生成1 mol D时同时生成1 mol A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【题目】已知:①H2(g)+ ![]() O2(g)=2H2O(g) △H1=akJ/mol
O2(g)=2H2O(g) △H1=akJ/mol
②2H2(g)+O2(g)=2H2O(g) △H2=b kJ/mol
③H2(g)+ ![]() O2(g)=H2O(l) △H3=ckJ/mol;
O2(g)=H2O(l) △H3=ckJ/mol;
④2H2(g)+O2(g)=2H2O(l) △H4=dkJ/mol。
下列关系正确的是
A. a<c<0 B. b>d>0 C. 2a=b<0 D. 2c=d>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家提出硅是“21世纪的能源”,这主要是由于作为半导体材料的硅在太阳能发电过程中具有重要的作用。下列关于硅的说法中错误的是
A.自然界中硅元素的储量丰富B.自然界中存在大量的单质硅
C.高纯度的硅被用作计算机芯片D.可用H2在高温下还原SiCl4的方法得到高纯硅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有下列各组物质:A.O2和O3; B.126C和136C;C.冰醋酸和乙酸; D.甲烷和庚烷; E.CH3CH2CH2CH3和CH3CH(CH3)CH3; F.淀粉和纤维素;G..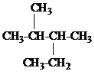 和
和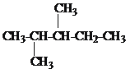 H.
H.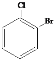 和
和![]() 。(填字母)
。(填字母)
①______组两物质间互为同位素。 ②______组两物质间互为同素异形体。
③______组两物质属于同系物。 ④______组两物质互为同分异构体。
⑤________组是同一物质。
(2)在下列变化中:①水的汽化、②NaCl熔化、③NaOH溶于水、④H2SO4溶于水、⑤O2溶于水、⑥NaHSO4溶于水、⑦Na2O2溶于水。
未发生化学键破坏的是________;(填序号,下同)仅破坏离子键的是________;仅破坏共价键的是________;既破坏离子键又破坏共价键的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOCl,熔点:-64.5 ℃,沸点:0.5 ℃,有毒)常温下是一种黄色气体,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成,并以液态储存。
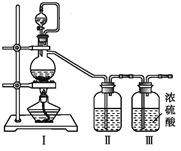
(1)甲组的同学拟制备原料气NO和Cl2,均采用上图制备装置:
①写出NOCl的N元素化合价:_______
②为制备纯净干燥的气体,下表中缺少的药品是(填写在横线上):
实验项目 | 装置Ⅰ | 装置Ⅱ | |
制备的气体 | 烧瓶中 | 分液漏斗中 | |
a .制备纯净干燥的Cl2 | MnO2 | _______ | _______ |
b .制备纯净干燥的NO | Cu | _______ | _______ |
(2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:
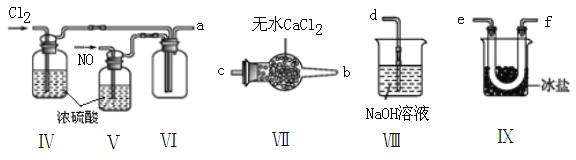
①装置连接顺序为a→____________________________(按气流自左向右方向,用小写字母表示)。
②装置Ⅳ、Ⅴ除可进一步干燥NO、Cl2外,另一个作用是______________________________。
③装置Ⅵ在实验结束,拆解装置前,应作怎样的处理?_________________________。
④装置Ⅷ中吸收尾气时,NOCl发生的非氧化还原反应的化学方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】细胞中常见的化学元素有20多种,其中有些含量较多,称为大量元素;有些含量很少,称为微量元素。下列各组元素中,全是微量元素的是
A.Fe、Mn、B、Mo、SB.C、H、O、Ca、Mg
C.P、N、K、Ca、MgD.Mo、Zn、Cu、B、Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有室温下四种溶液,有关叙述不正确的是
编号 | ① | ② | ③ | ④ |
pH | 10 | 10 | 4 | 4 |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸溶液 | 盐酸 |
A. 相同体积③、④溶液分别与NaOH完全反应,消耗NaOH物质的量:③>④
B. 分别加水稀释10倍,四种溶液的pH:①>②>④>③
C. ①、④两溶液等体积混合,所得溶液中c(NH4+)>c(Cl-)>c(OH-)>c(H+)
D. VaL④溶液与VbL②溶液混合(近似认为混合溶液体积=Va+Vb),若混合后溶液pH=5,则Va︰Vb=9︰11
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com