

| A. | 催化液化I中使用催化剂,反应的活化能Ea、△H2都减小 | |
| B. | 反应C(s)+H2O(g)+H2(g)=CH3OH(g)△H=41.1 kJ•mol-1 | |
| C. | △H2>△H3 | |
| D. | 图为甲醇燃料电池的工作原理,负极的电极反应为:CH3OH-6e-+6OH-═CO2+5H2O |
分析 A.催化剂能降低反应的活化能,但不能改变反应热;
B.①C(s)+2H2O(g)═CO2(g)+2H2(g);△H1=90.1KJ•mol-1
②CO2(g)+3H2(g)═CH3OH(g)+H2O(g);△H2=-49.0KJ•mol-1,①+②得,C(s)+H2O(g)+H2(g)=CH3OH(g)△H=41.1 KJ•mol-1;
C.CO2和H2完全燃烧生成甲醇和水,故反应②完全燃烧,反应③不完全燃烧,完全燃烧放出的热量大于不完全燃烧放出的热量,放热为负值,故△H2<△H3;
D.放电时,负极上甲醇失电子发生氧化反应,在碱性条件下电极反应式为:CH3OH-6e-+8OH-=CO32-+6H2O.
解答 A.催化剂能降低反应的活化能,但不能改变反应热,故Ea减小、△H2不变,故A错误;
B.①C(s)+2H2O(g)═CO2(g)+2H2(g);△H1=90.1KJ•mol-1
②CO2(g)+3H2(g)═CH3OH(g)+H2O(g);△H2=-49.0KJ•mol-1,①+②得,C(s)+H2O(g)+H2(g)=CH3OH(g)△H=41.1 KJ•mol-1,故B正确;
C.CO2和H2完全燃烧生成甲醇和水,故反应②完全燃烧,反应③不完全燃烧,完全燃烧放出的热量大于不完全燃烧放出的热量,放热为负值,故△H2<△H3,故C错误;
D.放电时,负极上甲醇失电子发生氧化反应,在碱性条件下电极反应式为:CH3OH-6e-+8OH-=CO32-+6H2O,故D错误,
故选B.
点评 本题考查热化学方程式的书写、盖斯定律的应用,电极方程式的书写,本题题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性溶液中可能大量存在Na+、I-、SO42-、ClO- | |
| B. | 弱碱性溶液中可能大量存在K+、Cl-、HCO3-、AlO2- | |
| C. | Fe(NO3)3溶液中加入足量HI溶液的反应:2Fe3++2I-=2Fe2++I2 | |
| D. | 向白色ZnS沉淀上滴加CuSO4溶液,白色沉淀变黑的离子方程式:ZnS(s)+Cu2+(aq)=CuS(s)+Zn2+(aq) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
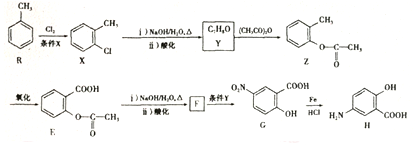
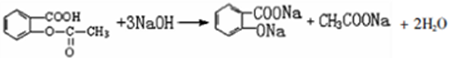 .
.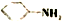 易被氧化;苯环上连有烷基时再引入一个取代基,常取代在烷基的邻、对位,当苯环上连有羧基时则取代在间位.据此以R为原料合成化合物
易被氧化;苯环上连有烷基时再引入一个取代基,常取代在烷基的邻、对位,当苯环上连有羧基时则取代在间位.据此以R为原料合成化合物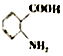 ,参照上述流程设计合成路线:
,参照上述流程设计合成路线: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,0.1mol•L-1HF溶液中pH=1 | |
| B. | Ksp(CaF2)随温度和浓度的变化而变化 | |
| C. | 该体系中没有沉淀产生 | |
| D. | 该体系中HF与CaCl2反应产生沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol Cl2参加反应转移电子数一定为2NA | |
| B. | 1mol NaHCO3晶体中阳离子数为2NA | |
| C. | 常温常压条件下,14g乙烯和丁烯混合物含有的共用电子对数为3NA | |
| D. | 1ml•L-1 NaCl溶液中含有的Na+数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| H2SO4溶液 | KMnO4溶液 | H2C2O4溶液 | 褪色时间(分:秒) |
| 1mL 2mol/L | 2mL 0.01mol/L | 1mL 0.1mol/L | 2:03 |
| 1mL 2mol/L | 2mL 0.01mol/L | 1mL 0.2mol/L | 2:16 |
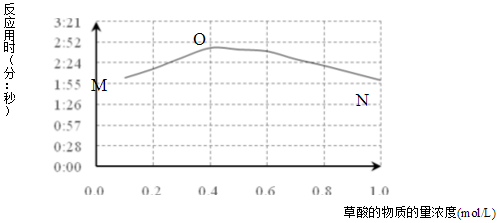
| a | KMnO4与H2C2O4反应是分步进行的,反应过程中生成Mn(VI)、Mn(III)、Mn(IV),最终变为无色的Mn(II).(括号中罗马数字表示锰的化合价) |
| b | 草酸根易与不同价态锰离子形成较稳定的配位化合物. |
| c | 草酸稳定性较差,加热至185℃可分解. |
| H2SO4溶液 | Na2SO4固体 | KMnO4溶液 | H2C2O4溶液 | 褪色时间(分:秒) |
| 1mL 0.1mol/L | 1.9×10-3mol | 2mL 0.01mol/L | 1mL 0.2mol/L | 16:20 |
| 1mL 0.5mol/L | 1.5×10-3mol | 2mL 0.01mol/L | 1mL 0.2mol/L | 8:25 |
| 1mL 1.0mol/L | 1.0×10-3mol | 2mL 0.01mol/L | 1mL 0.2mol/L | 6:15 |
| 1mL 2.0mol/L | 0 | 2mL 0.01mol/L | 1mL 0.2mol/L | 2:16 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com