

分析 A为黄绿色气体单质,则A为Cl2,与Fe反应生成H为FeCl3,E常温下为无色无味的液体,F为淡黄色粉末,二者反应生成B与G,应是过氧化钠与水反应生成氢氧化钠与氧气,则E为H2O,F为Na2O2,G为O2,B为NaOH,C、D分别为NaCl、NaClO中一种,据此解答.
解答 解:A为黄绿色气体单质,则A为Cl2,与Fe反应生成H为FeCl3,E常温下为无色无味的液体,F为淡黄色粉末,二者反应生成B与G,应是过氧化钠与水反应生成氢氧化钠与氧气,则E为H2O,F为Na2O2,G为O2,B为NaOH,C、D分别为NaCl、NaClO中一种.
(1)A和E反应的化学方程式为:Cl2+H2O?HCl+HClO,故答案为:Cl2+H2O?HCl+HClO;
(2)反应②的化学方程式为:2Na2O2+2H2O=4NaOH+O2↑,故答案为:2Na2O2+2H2O=4NaOH+O2↑;
(3)反应③在点燃的条件下发生,现象为:剧烈燃烧,产生红棕色的烟,反应的化学方程式为:2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3,
故答案为:剧烈燃烧,产生红棕色的烟;2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3.
点评 本题考查无机物推断,物质的颜色和状态是推断突破口,需要学生熟练掌握元素化合物知识.


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 目前加碘食盐主要添加的是KIO3 | |
| B. | 盐卤可用于制豆腐 | |
| C. | 明矾可用于水的杀菌,消毒 | |
| D. | 在空气质量日报中SO2含量属于空气污染指数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某校化学兴趣实验小组用流水抽气管对教材中氢气在氯气中燃烧的实验进行了改进,可有效地防治Cl2、HCl对环境的污染,其实验装置如图所示:
某校化学兴趣实验小组用流水抽气管对教材中氢气在氯气中燃烧的实验进行了改进,可有效地防治Cl2、HCl对环境的污染,其实验装置如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
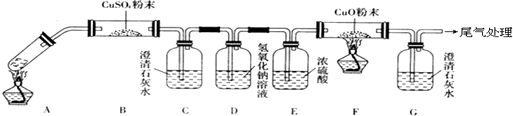
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 (苯胺,易被氧化)
(苯胺,易被氧化) ,其核磁共振氢谱图有4个吸收峰;
,其核磁共振氢谱图有4个吸收峰; ;
; ;
; 有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有6种;
有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有6种; 的流程:A$→_{Na/△}^{H_{2}}$甲→乙$\stackrel{Br_{2}/CCl_{4}}{→}$
的流程:A$→_{Na/△}^{H_{2}}$甲→乙$\stackrel{Br_{2}/CCl_{4}}{→}$ $→_{△}^{NaOH(aq)}$
$→_{△}^{NaOH(aq)}$
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题



查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2在有的反应中显示氧化性,有的反应中显示还原性 | |
| B. | SO2是酸性氧化物,溶于水生成稳定的亚硫酸 | |
| C. | SO2气体通入Na0H溶液中一定得到Na2SO3 | |
| D. | SO2气体通入BaCl2溶液中,能生成白色沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com