
工业上以煤和水为原料通过一系列转化可变为清洁能源氢气或工业原料甲醇。
(1)已知①C(s)+O2(g)=CO2(g) ΔH1
②2H2(g)+O2(g)=2H2O (l) ΔH2
③H2O (l)= H2O (g) ΔH3
则碳与水蒸气反应C(s)+2H2O(g) CO2(g)+2H2(g)的ΔH =________。
CO2(g)+2H2(g)的ΔH =________。
(2)工业上也可以仅利用上述反应得到的CO2和H2进一步合成甲醇,反应方程式为:CO2(g)+3H2(g) CH3OH(g)+H2O(g)ΔH<0
CH3OH(g)+H2O(g)ΔH<0
①工业生产过程中CO2和H2的转化率________(填“前者大”、“后者大”、“一样大”或“无法判断”),为了提高甲醇的产率可以采取的措施是_______________(填两点)。
②在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2进行上述反应。测得CO2和CH3OH(g)浓度随时间变化如下图所示。该温度下的平衡常数为______(保留三位有效数字)。
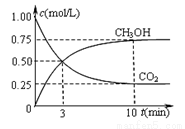
改变温度,使反应CO2(g)+3H2(g) CH3OH(g)+H2O(g)中的所有物质都为气态。起始温度体积相同(T1℃、2 L密闭容器).反应过程中部分数据见下表:
CH3OH(g)+H2O(g)中的所有物质都为气态。起始温度体积相同(T1℃、2 L密闭容器).反应过程中部分数据见下表:
反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
反应Ⅰ 恒温恒容 | 0min | 2 | 6 | 0 | 0 |
10min | 4.5 | ||||
20min | 1 | ||||
30min | 1 | ||||
反应Ⅱ 绝热恒容 | 0min | 0 | 0 | 2 | 2 |
①达到平衡时,反应Ⅰ、Ⅱ对比:平衡常数K(Ⅰ)___K(Ⅱ)(填“>”、“<”或“=”,下同);平衡时CH3OH的浓度c(Ⅰ)___c(Ⅱ)。
②对反应Ⅰ,前10 min内的平均反应速率υ(CH3OH)=______,若30 min时只向容器中再充入1 mol CO2(g)和1 mol H2O(g),则平衡_____移动(填“正向”、“逆向”或“不”)。
科目:高中化学 来源:2017届重庆市高三适应性月考(五)理综化学试卷(解析版) 题型:实验题
氯化亚铜(CuCl)广泛用于化工、印染、有机合成等行业。CuCl难溶于醇和水,可溶于氯离子浓度较大的体系,在潮湿空气中易水解氧化。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产氯化亚铜的工艺过程如下图所示。

回答下列问题:
(1)CuCl中Cu元素在周期表中的位置为___________。
(2)步骤①中N元素被还原为最低价,则Cu溶解的离子方程式为________。溶解温度应控制在60~70℃,原因是______________。
(3)写出步骤③中主要反应的离子方程式________。(NH4)2SO3要适当过量,目的有:保证Cu2+的还原速率,__________。已知NH4Cl、Cu2+的物质的量之比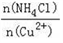 与Cu2+沉淀率的关系如图所示,当氯化铵用量增加到一定浓度后氯化亚铜的沉淀率减少,原因是________。
与Cu2+沉淀率的关系如图所示,当氯化铵用量增加到一定浓度后氯化亚铜的沉淀率减少,原因是________。
(4)步骤⑥加入乙醇洗涤的目的是__________。
(5)氯化亚铜的定量分析:
①称取样品0.250g和10mL过量的FeCl3溶液于250mL锥形瓶中,充分溶解;
②用0.100mol·L-1硫酸铈[Ce(SO4)2]标准溶液测定。已知:CuCl+FeCl3=CuCl2+FeCl2、Fe2++Ce4+=Fe3++Ce3+。
三次平衡实验结果如下表(平衡实验结果相差不能超过1%):
平衡实验次数 | 1 | 2 | 3 |
0.250g样品消耗硫酸铈标准溶液的体积(mL) | 24.35 | 24.05 | 23.95 |
则样品中CuCl的纯度为_______(结果保留3位有效数字)。
查看答案和解析>>
科目:高中化学 来源:2017届湖南省衡阳市高三第二次质检化学试卷(解析版) 题型:选择题
下列化学用语表示正确的是
A. Mg2+的结构示意图: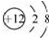 B. 葡萄糖的结构简式:C6H12O6
B. 葡萄糖的结构简式:C6H12O6
C. H2O2的电子式: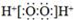 D. 硫酸的电离方程式:H2SO4═H22++SO42﹣
D. 硫酸的电离方程式:H2SO4═H22++SO42﹣
查看答案和解析>>
科目:高中化学 来源:2016~2017学年江苏省宿迁市高二学业水平测试模拟(二)化学试卷(解析版) 题型:选择题
下列物质中含有共价键的离子化合物是
A. CaCl2 B. NH4HCO3 C. Na2O D. H2O2
查看答案和解析>>
科目:高中化学 来源:2016~2017学年江苏省宿迁市高二学业水平测试模拟(二)化学试卷(解析版) 题型:选择题
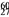 Co在核治疗肿瘤上有着广泛的应用。下列关于
Co在核治疗肿瘤上有着广泛的应用。下列关于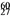 Co的说法正确的是
Co的说法正确的是
A. 质量数是27 B. 质子数是27 C. 电子数是33 D. 中子数是60
查看答案和解析>>
科目:高中化学 来源:2017届湖北省七市(州)高三第一次联合调考(3月联考)理科综合化学试卷(解析版) 题型:选择题
X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76 g/L;W的质子数是X、Y、Z、M四种元素质子数之和的1/2。下列说法错误的是
A. 原子半径:W>X>Y>Z>M
B. XZ2为直线形的共价化合物
C. X、Y、Z 分别与M元素形成的最简单化合物的沸点依次升高
D. 由X、Y、Z、M四种元素形成的化合物一定含有离子键和共价键
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省湛江市高二上学期期末调研考试化学试卷(解析版) 题型:填空题
在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
时间(s) C(mol/L) | 0 | 20 | 40 | 60 | 80 | 100 |
C(N2O4) | 0. 20 | a | 0.10 | c | d | e |
C(NO2) | 0.00 | 0.12 | b | 0.22 | 0.22 | 0.22 |
反应进行至100s后将反应混合物的温度降低,发现气体的颜色变浅。
(1)该反应的化学方程式为__________________________,表中b_________c(填“<”、“=”、“>”)。
(2)20s时,N2O4的的浓度为__________________mol·L-1,0~20s内N2O4的平均反应速率为________________;
(3)该反应的平衡常数表达式K=___________________
在80℃时该反应的平衡常数K值为:______________(保留到小数点后2位)。
(4)在其他条件相同时,该反应的K值越大,表明建立平衡时____________。
A.N2O4的转化率越高 B.NO2的产量越大
C.N2O4与NO2的浓度之比越大 D.正反应进行的程度越大
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省湛江市高二上学期期末调研考试化学试卷(解析版) 题型:选择题
在密闭容器里,A与B反应生成C,其反应速率分别用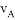 、
、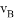 、
、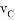 表示,已知2
表示,已知2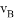 =3
=3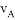 、3
、3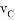 =2
=2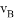 ,则此反应可表示为
,则此反应可表示为
A. 2A+3B=2C B. A+3B=2C
C. 3A+B=2C D. A+B=C
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省张家口市高二上学期期末考试化学试卷(解析版) 题型:选择题
下列说法正确的是
A. 用直接加热并蒸干FeCl3溶液的方法可制得纯净的无水FeCl3
B. 等物质的量浓度的Na2CO3溶液和CH3COONa溶液的pH,前者大于后者
C. 中和等体积、等物质的量浓度的盐酸和醋酸溶液,消耗NaOH的物质的量不相等
D. 对于有气体参加的反应,增大气体反应物浓度,活化分子百分数增大,反应速率加快
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com