
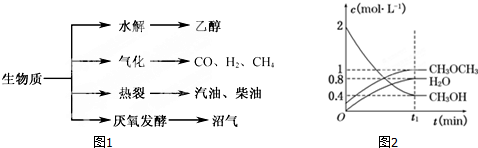
| c(CH3OCH3)?c(H2O) |
| c2(CH3OH) |
| c(CH3OCH3)c(H2O) |
| C 2(CH3OH) |
| c(CH3OCH3)c(H2O) |
| C 2(CH3OH) |
| 0.8��1 |
| 0��42 |
| c(CH3OCH3)c(H2O) |
| C 2(CH3OH) |
| c(CH3OCH3)c(H2O) |
| C 2(CH3OH) |
| 1.2��0.6 |
| 0��42 |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��0.1mol/L MgCl2��Һ��Cl-������Ϊ0.2NA |
| B��19.2gͭ��������ϡ���ᷴӦ����NO�����Ϊ4.48L |
| C����״���£�33.6L H2O����9.03��1023��H2O���� |
| D��46g NO2��N2O4�Ļ������ԭ������Ϊ3NA�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 50mL 0.50mol/L������50mL 0.55mol/L NaOH��Һ����ͼ��ʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȣ��ش��������⣺
50mL 0.50mol/L������50mL 0.55mol/L NaOH��Һ����ͼ��ʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȣ��ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| Cu |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
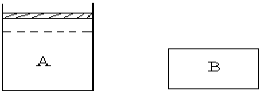 ��A��B����������AΪ��ѹ������BΪ��������������ͬ�¶���A�г���1molN2��3molH2��B�г���0.5molN2��1.5molH2����ʱVA=2VB��ά���¶Ȳ��䣬A��B�еķ�Ӧ���ﵽƽ�⣮ƽ��ʱ���������з�Ӧ�ų��������ֱ�ΪQAkJ��QBkJ��A�������������Ϊ��ʼʱ��
��A��B����������AΪ��ѹ������BΪ��������������ͬ�¶���A�г���1molN2��3molH2��B�г���0.5molN2��1.5molH2����ʱVA=2VB��ά���¶Ȳ��䣬A��B�еķ�Ӧ���ﵽƽ�⣮ƽ��ʱ���������з�Ӧ�ų��������ֱ�ΪQAkJ��QBkJ��A�������������Ϊ��ʼʱ��| 4 |
| 5 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A���۱�ϩ�Ľṹ��ʽΪ�� |
B��������ӵ����ģ��Ϊ��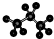 |
C�����Ȼ�̼���ӵĵ���ʽΪ��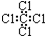 |
| D����ϩ�Ľṹ��ʽ��CH2CH2 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com