
【题目】以铅蓄电池为电源.将CO2转化为乙烯的装置如图所示,电解所用电极材料均为惰性电极。下列说法不正确的是( )
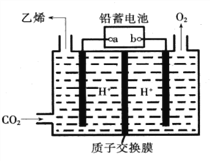
A. b为铅蓄电池的正极
B. 每生成1mol乙烯,理论上铅蓄电池中消耗12mol硫酸
C. 电解过程中,阳极区溶液中c(H+)逐渐减小
D. 阴极反应式:2CO2+12H++12e-=C2H4+4H2O
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某酯A,其分子式C6H12O2,已知有机物A、B、C、D、E有如图的转化关系,又知C不能发生银镜反应,E能发生银镜反应,则A结构可能有
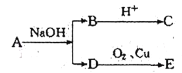
A.5种B.6种C.8种D.9种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2CO3和NaHCO3在生活和生产中应用广泛。
(1)室温时下列指定溶液中微粒物质的量浓度关系正确的是_____ (填字母) .
A.0.1mol·L-1的Na2CO3溶液: c(Na+)+c(H+) =c(OH-)+c(![]() )+c(
)+c(![]() )
)
B.0.1mol·L-1的NaHCO3溶液: c(Na+) =c(![]() ) + c(
) + c(![]() )+ c(H2CO3)
)+ c(H2CO3)
C.0.1mol·L-1的NaHCO3溶液: c(Na+)>c(![]() )>c(
)>c(![]() )>c(H2CO3)
)>c(H2CO3)
D.浓度均为0.1mol·L-1的Na2CO3和NaHCO3混合溶液:2c(H+)+c(![]() )+3c(H2CO3)=2c(OH-)+c(
)+3c(H2CO3)=2c(OH-)+c(![]() )
)
(2)水垢中的CaSO4可用Na2CO3溶液处理。当两种沉淀共存时,  =________;[Ksp(CaCO3) =5.0×10-9、Ksp(CaSO4)=7.0×10-5]
=________;[Ksp(CaCO3) =5.0×10-9、Ksp(CaSO4)=7.0×10-5]
(3) 25℃时,碳酸及其盐溶液中含碳元素微粒的分布分数δ随溶液pH变化的关系如图所示。
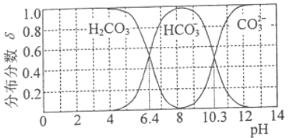
①纯碱溶液去油污的原理是_________(用离子方程式表示) 。25℃时,该反应的平衡常数表示为Kh,则pKh=_________(pKh=-lgKh)。
②25C时,下列三种溶液
A.0.1mol·L-1的NaHCO3溶液:
B.0.1mol·L-1的Na2CO3溶液:
C.0.1mol·L-1的NaCN溶液。
pH由大到小的顺序为________________(填字母)。[25℃时,K(HCN)= 10-9.3]
(4)NaHCO3可用于铝土矿(主要成分为Al2O3,含SiO2和Fe2O3)制铝。流程如下:
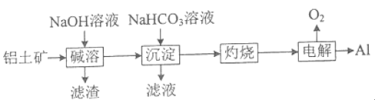
①滤渣中除含SiO2转化得到的铝硅酸钠外,还含_____(填化学式) 。
②写出“沉淀"步骤发生反应的离子方程式________和________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸二氢钾(KH2PO4)是一种大型非线性光学晶体,在未来能源领域——“人造太阳”计划中有重要作用.以氯磷灰石(主要成分为Ca5(PO4)3Cl,还含有少量Al2O3、Fe2O3等杂质)为原料制备KH2PO4的一种工艺流程如图所示:
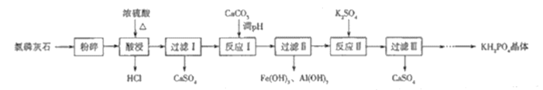
已知:①离子完全沉淀时的pH为Fe3+:3.5,Al3+:5.2.
②Ca3(PO4)2与CaHPO4均难溶于水,Ca(H2PO4)2能溶于水
(1)已知“酸浸”时发生反应的化学方程式为![]() ,该反应体现了浓硫酸的______________________性和___________________性.
,该反应体现了浓硫酸的______________________性和___________________性.
(2)如果将原料改为氟磷灰石,则“酸浸”时不能使用玻璃容器,原因是______________________.
(3)“反应Ⅱ”的化学方程式为________________________________________.
(4)常温下磷酸的电离平衡常数![]() 、
、![]() 、
、![]() ,
,![]() 的电离常数
的电离常数![]() 、
、![]() ,则常温下KH2PO4水溶液显____________________(填“酸性”“碱性”或“中性”);将少量磷酸滴入碳酸钠溶液中反应的离子方程式为______________________________.
,则常温下KH2PO4水溶液显____________________(填“酸性”“碱性”或“中性”);将少量磷酸滴入碳酸钠溶液中反应的离子方程式为______________________________.
(5)KH2PO4也可以通过如图所示装置电解制备:
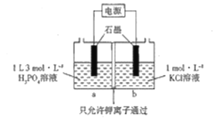
则阳极的电极反应式为___________________.假如通电前a、b两室溶液的质量相等,若有2NA个K+通过交换膜,则两室溶液的质量差为__________________g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑩种元素,请用化学用语回答下列问题:
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | ⑥ | ⑦ | ⑧ | |||||
3 | ① | ③ | ⑤ | ⑨ | ⑩ | |||
4 | ② | ④ |
(1)在③~⑦元素中,原子半径最大的是__________(填元素符号);
(2)⑦元素的最高价氧化物对应的水化物与其氢化物能生成盐M,M中含有的化学键类型有__________________;
(3)写出元素①和⑧的单质在加热条件下反应生成的化合物的电子式:_________。
(4
(5)①~⑨中元素最高价氧化物对应的水化物中酸性最强的是_____________(填物质化学式);呈两性的氢氧化物是_________(填物质化学式),该化合物与NaOH溶液反应的离子方程式为___________。
(6)用电子式表示元素③与⑨形成化合物的过程_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是
A. 工业上用电解法制备烧碱: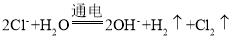
B. 用食醋除去水垢中的CaCO3:CaCO3+2H+=Ca2++H2 O+ CO2↑
C. NH4HCO3溶液中加过量NaOH溶液并加热:NH4++OH-![]() H2O+NH3↑
H2O+NH3↑
D. 铜溶于硫酸酸化的过氧化氢溶液:Cu+2H++H2O2=Cu2++2H2 O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),但CaC2晶体中由于哑铃形的C![]() 存在,使晶胞沿一个方向拉长。下列关于CaC2晶体的说法中正确的是:
存在,使晶胞沿一个方向拉长。下列关于CaC2晶体的说法中正确的是:
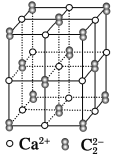
A.1个Ca2+周围距离最近且等距离的C![]() 数目为6
数目为6
B.该晶体中的阴离子与F2是等电子体
C.6.4 g CaC2晶体中含阴离子0.1 mol
D.与每个Ca2+距离相等且最近的Ca2+共有12个
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com