
【题目】Cu2O是重要的催化剂和化工原料,工业上制备Cu2O的主要反应如下:
Ⅰ.C(g)+CO2(g)![]() 2CO(g) ΔH=+172.5kJ/mol
2CO(g) ΔH=+172.5kJ/mol
Ⅱ.CO(g)+2CuO(s)![]() Cu2O(s)+CO2(g)ΔH=-138.0KJ/mol
Cu2O(s)+CO2(g)ΔH=-138.0KJ/mol
请回答:
(1)C与CuO反应生成Cu2O和CO的热化学方程式为_____________,一定温度下,该反应在密闭容器中达到平衡后,只增大容器的容积,再次达到平衡时,CO的平衡浓度_________(填“增大”、“减小”或“不变”)。
(2)一定温度下,向5L恒容密闭容器中加入1molCO和2molCuO,发生反应Ⅱ.5min时达到平衡,测得容器中CuO的物质的量为0.8mol。
①0-5min内,用CO2表示的反应速率v(CO2)=___________.
②CO的平衡转化率a=____________.
(3)向5L密闭容器中加入1molC和1molCO2,发生反应Ⅰ。 CO2、CO的平衡体积分数(φ)与温度(T)的关系如图所示。
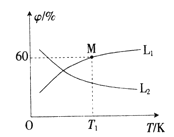
①能表示CO2的平衡体积分数与温度关系的曲线为___________(填"L1”或“L2”),理由为________。
②温度为T1时,该反应的平衡常数K=_____________。
(4)其他条件不变时,若水的分解反应用Cu2O作催化剂,则该反应的活化能_____(填“增大”、“减小”或“不变”,下同), 反应热(ΔH)____________。
【答案】 C(s)+2CuO(s)![]() Cu2O(s)+CO(g) ΔH=+34.5 kJ·mol-1 不变 0.024 mol·L-1·min-1 60% L2 该反应为吸热反应,温度升高,平衡正移,CO2的平衡体积分数减小
Cu2O(s)+CO(g) ΔH=+34.5 kJ·mol-1 不变 0.024 mol·L-1·min-1 60% L2 该反应为吸热反应,温度升高,平衡正移,CO2的平衡体积分数减小 ![]() 减小 不变
减小 不变
【解析】(1)已知Ⅰ.C(g)+CO2(g)![]() 2CO(g) ΔH=+172.5kJ/mol
2CO(g) ΔH=+172.5kJ/mol
Ⅱ.CO(g)+2CuO(s)![]() Cu2O(s)+CO2(g)ΔH=-138.0KJ/mol
Cu2O(s)+CO2(g)ΔH=-138.0KJ/mol
根据盖斯定律,由得Ⅰ+Ⅱ反应C(s)+2CuO(s)![]() Cu2O(s)+CO(g) ΔH=+172.5kJ/mol-138.0kJ/mol=+34.5 kJ·mol-1,C(s)+2CuO(s)
Cu2O(s)+CO(g) ΔH=+172.5kJ/mol-138.0kJ/mol=+34.5 kJ·mol-1,C(s)+2CuO(s)![]() Cu2O(s)+CO(g)为气体体积增大的反应,增大容器的体积,相当于减小压强,平衡向气体增大的正反应方向移动,CO的量增多,反应体积只有一种气体,气体增大的量与容器体积增大成正比,故平衡浓度不变;
Cu2O(s)+CO(g)为气体体积增大的反应,增大容器的体积,相当于减小压强,平衡向气体增大的正反应方向移动,CO的量增多,反应体积只有一种气体,气体增大的量与容器体积增大成正比,故平衡浓度不变;
(2) CO(g)+2CuO(s)![]() Cu2O(s)+CO2(g)
Cu2O(s)+CO2(g)
开始时的物质的量 1mol 2mol 0 0
改变的物质的量 0.6mol 1.2mol 0.6mol 0.6mol
平衡时的物质的量 0.4mol 0.8mol 0.6mol 0.6mol
①0-5min内,用CO2表示的反应速率v(CO2)= 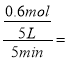 0.024 mol·L-1·min-1;②CO的平衡转化率a=
0.024 mol·L-1·min-1;②CO的平衡转化率a=![]() ;(3)①该反应为吸热反应,温度升高,平衡正移,CO2的平衡体积分数减小,故能表示CO2的平衡体积分数与温度关系的曲线为L2;②温度为T1时,CO的平衡体积分数(φ)为60%,设平衡时二氧化碳的转化率为x,则
;(3)①该反应为吸热反应,温度升高,平衡正移,CO2的平衡体积分数减小,故能表示CO2的平衡体积分数与温度关系的曲线为L2;②温度为T1时,CO的平衡体积分数(φ)为60%,设平衡时二氧化碳的转化率为x,则
C(s)+CO2(g) ![]() 2CO(g)
2CO(g)
开始时的浓度(mol/L) 0.2 0
改变的浓度(mol/L) 0.2x 0.4x
平衡时的浓度(mol/L) 0.2-0.2x 0.4x
![]() =60%,解得x=
=60%,解得x=![]() ,CO2、CO的平衡浓度分别为
,CO2、CO的平衡浓度分别为![]() mol/L、
mol/L、![]() mol/L,故反应的平衡常数K=
mol/L,故反应的平衡常数K=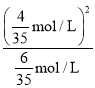 =
=![]() ;(4)作催化剂能降低反应的活化能,但不能改变反应热(ΔH),故活化能减小,反应热不变。
;(4)作催化剂能降低反应的活化能,但不能改变反应热(ΔH),故活化能减小,反应热不变。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列有关说法,不正确的是

A. 甲图四种化合物中“0”内A所对应含义的解释有一个是错误的
B. 硝化细菌体内含有甲图中的四种化合物
C. 若乙图表示某种酶在不同温度下催化某反应的效果图,则温度a>b>c
D. 若乙图表示不同浓度的某种酶催化某反应的效果图,则酶浓度a>b>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F是原子序数依次增大的前四周期元素。A是宇宙中含量最丰富的元素;D与E同主族,且E的原子序数是D的两倍;B与D组成的化合物是一种温室气体;C元素原子最外层P能级比S能级多1个电子;F原子的最外层电子数与A相同,其余各层电子均充满。据此回答下列问题。
(1)F元素形成的高价基态离子的核外电子排布式为____________________________。
(2)E的一种具有强还原性的氧化物分子的VSEPR模型为____________________。
(3)C、D、E元素的第一电离能由大到小排序_________________。(用元素符号表示)
(4)A和D形成的18电子化合物可将碱性工业废水中的CN-氧化为碳酸盐和氨,相应的离子方程式为___________________________。
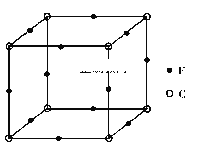
(5)F与C形成化合物的晶胞如图所示,该化合物的化学式为__________,C离子的配位数是_________。此立方晶体的边长为a cm,则该晶体密度为__________g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】TiCl4是由钛精矿(主要成分为TiO2)制备钛(Ti)的重要中间产物,制备纯TiCl4的流程示意图如下:

资料:TiCl4及所含杂质氯化物的性质
化合物 | SiCl4 | TiCl4 | AlCl3 | FeCl3 | MgCl2 |
沸点/℃ | 58 | 136 | 181(升华) | 316 | 1412 |
熔点/℃ | 69 | 25 | 193 | 304 | 714 |
在TiCl4中的溶解性 | 互溶 | —— | 微溶 | 难溶 | |
(1)氯化过程:TiO2与Cl2难以直接反应,加碳生成CO和CO2可使反应得以进行。
已知:TiO2(s)+2 Cl2(g)= TiCl4(g)+ O2(g) 2C(s)+O2(g)=2CO(g)
① 沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的化学方程式:________________
② 氯化反应的尾气须处理后排放,尾气中的HCl和Cl2经吸收可得粗盐酸、FeCl3溶液,则尾气的吸收液依次是_____________________。
③ 氯化产物冷却至室温,经过滤得到粗TiCl4混合液,则滤渣中含有_____________
(2)精制过程:粗TiCl4经两步蒸馏得纯TiCl4。示意图如下:
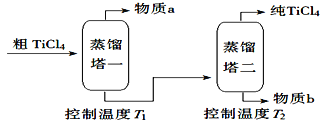
物质a是_________,T2应控制在_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】富马酸(反式丁烯二酸)可用于制备聚酯树脂、医药等。实验室以石油的裂解产物之一A为原料制备富马酸及其衍生物的一种工艺路线如下:
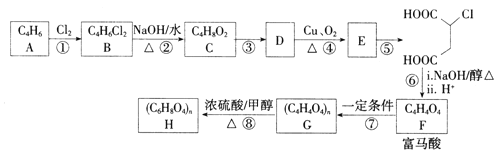
已知:链烃A的核磁共振氢谱中有2组吸收峰。
(1)A的化学名称为________,B的结构简式为__________。
(2)③的反应类型为________.检验E中含氧官能团所用的试剂为___________。
(3)反应④的化学方程式为___________。
(4)反应⑧的化学方程式为______________。
(5)富马酸的同分异构体中,同为二元羧酸的还有__________(包括顺反异构)。
(6)已知: 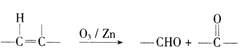 ,参照上述合成路线,以
,参照上述合成路线,以![]() 为原料( 无机试剂任选).设计制备
为原料( 无机试剂任选).设计制备![]() 的合成路线:_____________________。
的合成路线:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置能达到实验目的的是( )




①除去CO2中HCl ②吸收Cl2 ③检查装置气密性 ④利用排空气法收集CO2
A. ①④ B. ②④ C. ②③ D. ①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年诺贝尔化学奖由法国、美国及荷兰的三位化学家分获,以表彰他们在分子机器设计与合成领域方面的成就,其中一种光驱分子马达结构如右图所示。有关该分子的说法不正确的是

A. 光驱分子马达的分子式是C34H46O2,属于烃的含氧衍生物
B. 分子机器设计与合成的研究成果为未来新材料的研发开启了广阔前景
C. 三位科学家通过研究质子和中子重新合成了新的元素
D. 光驱分子马达能与NaHCO3和酸性KMnO4溶液反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com