
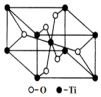
 钛呈银白色,因它坚硬、强度大、耐热、密度小,被称为高技术金属.目前生产钛采用氯化法,即将金红石或钛铁矿与焦炭混合,通入氯气并加热制得TiCl4:
钛呈银白色,因它坚硬、强度大、耐热、密度小,被称为高技术金属.目前生产钛采用氯化法,即将金红石或钛铁矿与焦炭混合,通入氯气并加热制得TiCl4:分析 (1)钛是22号元素,其原子核外有22个电子,3d、4s电子为其价电子,根据构造原理书写;
(2)根据等电子体的定义,只要原子数目和电子总数(或价电子总数)相同就是等电子体;
(3)根据价电子对互斥理论确定原子的杂化方式,价层电子对个数=σ键个数+孤电子对个数;
(4)每个碳原子周围有一个碳碳双键和两个碳碳单键,均为两个碳原子共用,所以每个碳实际占有的碳碳双键数为0.5,而每个双键中有1个σ键、1个π键;计算36g C60的物质的量,结合分子含有30个C=C双键计算吸收氢气的体积;
(5)配合物由内界和外界组成,配合物溶于水发生电离生成内界离子(络离子)和外界离子,加入AgNO3溶液时,无明显现象,说明溴离子为配合物的内界配体,加BaCl2溶液时若,产生白色沉淀,说明硫酸根离子为外界离子,据此书写配离子化学式;
(6)观察晶胞,数数Ti周围距离最近的O的个数即为Ti的配位数.
解答 解:(1)Ti是22号元素,核外电子排布式为1s22s22p63s23p63d24s2,价电子排布式为为3d24s2;
故答案为:3d24s2;
(2)根据等电子体的定义,CO的等电子体必须是双原子分子或离子,且电子总数相等,如果是阳离子离子,原子序数之和减去所带电荷数值等于电子数,如:NO+,O22+,如果是阴离子,原子序数之和加上所带电荷数值等于电子数,如CN-,C22-;
故答案为:CN-(或NO+、C22-);
(3)CH2Cl2中价层电子对个数=4+$\frac{1}{2}$(4-4×1)=4且不含孤电子对,所以C原子采用sp3杂化,C6H6连接3个原子,形成3个θ键,无孤电子对,属于sp2杂化,CO2分子中C原子价层电子对个数是2且不含孤电子对,为直线形分子,所以碳原子采取sp杂化,C2H4中每个碳原子价层电子对个数为3且不含孤电子对,所以C原子采用sp2杂化,
故答案为:CO2;
(4)C60分子中每个碳原子周围有一个碳碳双键和两个碳碳单键,均为两个碳原子共用,所以每个碳实际占有的碳碳双键数为0.5,而每个双键中有1个σ键、1个π键,故该分子中σ键和π键的个数比3:1,36g C60的物质的量为$\frac{36g}{720g/mol}$=0.05mol,含有碳碳双键为0.05mol×30=1.5mol,最多可以吸收标准状况下的氢气为1.5mol×22.4L/mol=33.6L.
故答案为:33.6;
(5)配合物由内界和外界组成,配合物溶于水发生电离生成内界离子(络离子)和外界离子,其中一种化学式为[Co(NH3)5Br]SO4,硫酸根离子为外界离子,往其溶液中加BaCl2溶液时,现象是产生白色沉淀,往另一种配合物的溶液中加入BaCl2溶液时,无明显现象,说明硫酸根离子为配合物的内界配体,若加入AgNO3溶液时,产生淡黄色沉淀,说明溴离子为配合物的外界配体,所以化学式为[Co (NH3)5SO4]Br,
故答案为:产生白色沉淀;[Co (NH3)5SO4]Br;
(6)观察晶胞结构,可知每个钛周围距离最近的氧原子有6个,即钛的配位数为6,
故答案为:6.
点评 本题综合考查物质的结构与性质知识,侧重于电子排布式、等电子体、杂化类型、化学键、配合物的组成及性质等知识,题目难度中等,注意把握杂化类型的判断方法、配合物内界离子(络离子)和外界离子的判断为易错点.


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | Rb与冷水反应比K更剧烈 | B. | Rb投入CuSO4溶液中可置换出Cu | ||
| C. | Rb与O2反应只有Rb2O产生 | D. | Rb2CO3难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
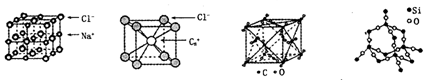
| A. | 同一主族的元素与另一相同元素所形成的化学式相似的物质不一定具有相同 的晶体结构 | |
| B. | 氯化钠、氯化铯和二氧化碳的晶体都有立方的晶胞结构,它们具有相似物理 性质 | |
| C. | 二氧化碳晶体是分子晶体,其中不仅存在分子间作用力,而且也存在共价键 | |
| D. | 二氧化硅晶体不是密堆积结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳原子之间,碳原子与其他原子(如氢原子)之间都可以形成4个共价键 | |
| B. | 碳原子性质活泼,可以与多数非金属元素原子形成共价键 | |
| C. | 碳原子之间既可以形成稳定的单键,又可以形成双键和三键 | |
| D. | 多个碳原子可以形成长度不同的链及环,且链、环之间又可以相互结合 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
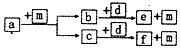 短周期元素W、X、Y、Z的原子序数依次递增,a、b、c、d、e、f是由这些元素组成的化合物,d为离子化合物,其结构中还含非极性共价键,m为元素Y的单质,通常为无色无味的气体.上述物质的转化关系如图所示.下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次递增,a、b、c、d、e、f是由这些元素组成的化合物,d为离子化合物,其结构中还含非极性共价键,m为元素Y的单质,通常为无色无味的气体.上述物质的转化关系如图所示.下列说法正确的是( )| A. | 原子半径:W<X<Y<Z | |
| B. | 阴离子的还原性:Y>W | |
| C. | 图中物质的转化过程均为氧化还原反应 | |
| D. | a一定由W、X两种元素组成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com