
| A. | MgF2的电子式: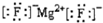 | B. | 二甲醚的结构式:CH3-O-CH3 | ||
| C. | NH3的球棍模型: | D. | 氧原子的结构示意图: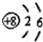 |
分析 A、氟化镁为离子化合物,由镁离子和氟离子构成;
B、二甲醚为甲醇分子发生分子间脱水生成的有机物;
C、氨气为三角锥的空间构型;
D、氧原子的核内有8个质子,核外有8个电子.
解答 解:A、镁原子失去2个电子形成镁离子,氟原子得到1个电子形成氟离子,1个镁离子与2个氟离子通过离子键结合形成氟化镁,电子式为: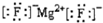 ,故A正确;
,故A正确;
B、二甲醚分子中氧原子连接了两个甲基,甲醚的结构式为: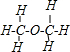 ,故B错误;
,故B错误;
C、氨气为三角锥的空间构型,故氨气的球棍模型为 ,故C正确;
,故C正确;
D、氧原子的核内有8个质子,核外有8个电子,故氧原子的结构示意图为 ,故D正确.
,故D正确.
故选B.
点评 本题考查了常见的化学用语,难度不大,应注意区分共价化合物和离子化合物电子式的书写和结构简式、结构式的区别.


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:实验题
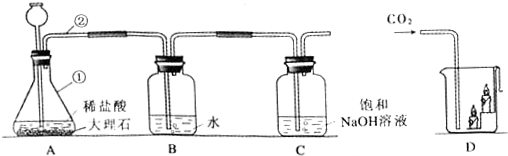
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
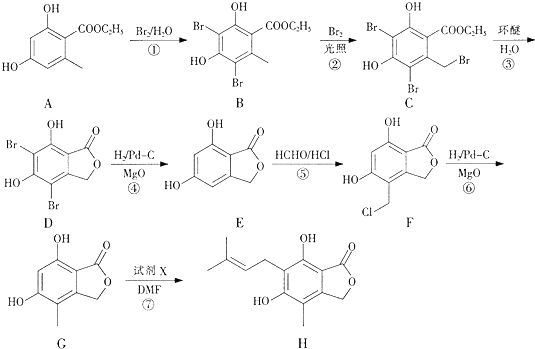
 (任写一种).
(任写一种). 或
或 .
.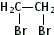
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
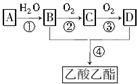 已知:①A是石油裂解气的主要成分,是一种相对分子质量为28的气态烃,A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2$→_{△}^{催化剂}$2CH3COOH.现以A为主要原料合成乙酸乙酯,其合成路线如下:
已知:①A是石油裂解气的主要成分,是一种相对分子质量为28的气态烃,A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2$→_{△}^{催化剂}$2CH3COOH.现以A为主要原料合成乙酸乙酯,其合成路线如下:查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
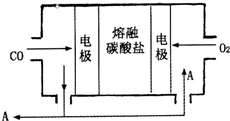 用Na2CO3熔融盐作电解质,CO、O2为原料组成的新型电池的研究取得了重大突破.该电池示意图如图:负极电极反应式为2CO-4e-+2CO32-=4CO2,为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环.A物质的化学式为CO2.
用Na2CO3熔融盐作电解质,CO、O2为原料组成的新型电池的研究取得了重大突破.该电池示意图如图:负极电极反应式为2CO-4e-+2CO32-=4CO2,为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环.A物质的化学式为CO2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
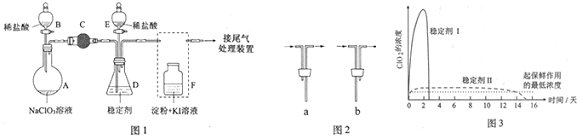
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com