
| A、足量Zn与一定量的浓硫酸反应,产生22.4L(标况)气体时,转移的电子数为2NA |
| B、一定条件下,32gO2和足量的铁粉充分反应,转移的电子数为4NA |
| C、4.6g乙醇和甲酸(HCOOH)的混合物中含有的碳原子数在0.1NA-0.2NA之间 |
| D、分子总数为NA的NO和NH3混合气体中含有的氮原子数为2NA |
| m |
| M |
| m |
| M |
| 32g |
| 32g/mol |


科目:高中化学 来源: 题型:
| A、(CH3COO)2 Pb+H2S=PbS↓+2 CH3COOH |
| B、Pb2++H2S=PbS↓+2H+ |
| C、Pb2++2 CH3COO-+H2S=PbS↓+2 CH3COOH |
| D、Pb2++2 CH3COO-+2H++S2-=PbS↓+2 CH3COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
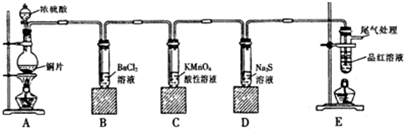
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①⑤ | B、②④ | C、②④⑤ | D、①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
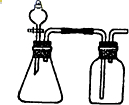
| A、①③ | B、①⑤ | C、④⑤ | D、⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| 高温高压 |
| A、使用铁触媒,可使氮气和氢气混合气体之间的反应在较低温度下取得较高的反应速率 |
| B、工业上选择上述条件下合成氨,可以使氮气全部转化为氨 |
| C、上述化学平衡的移动受到温度、反应物的浓度、压强等因素的影响 |
| D、温度升高,不利于氮气的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 不纯物 | 除杂试剂 | 分离方法 |
| A | CH4(C2H4) | 酸性KMnO4溶液 | 洗气 |
| B | 苯(苯酚) | 溴水 | 过滤 |
| C | 乙酸乙酯(乙酸) | NaOH溶液 | 蒸馏 |
| D | KNO3(NaCl) | 水 | 重结晶 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
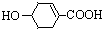 ,则莽草酸
,则莽草酸| A、遇FeCl3溶液呈紫色 |
| B、能发生消去反应 |
| C、能与H2发生加成反应 |
| D、1 mol莽草酸只能与1 mol NaOH反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com