
分析 (1)根据溶液稀释前后溶质的物质的量不变计算所需浓硫酸溶液的体积;根据浓硫酸的体积选取量筒,注意所选量筒的容积应稍大于或等于量取溶液的体积;
(2)根据该物理量是否有溶液的体积有关判断;
(3)依据容量瓶构造及使用方法判断;
(4)分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析.
解答 解:(1).设浓硫酸的体积为V,18mol/L×V=0.1L×3.0mol/L,解得:V=0.0167L=16.7mL;选取量筒的容积应稍大于或等于量取溶液的体积,则所用量筒的规格是25mL;
故答案为:16.7;B;
(2)A.溶液中H2SO4的物质的量=nV,所以与溶液的体积有关,故A不选;
B.溶液具有均一性,溶液的浓度与体积无关,故B选;
C.溶液中SO42-的数目=nNA=CVNA,所以与溶液的体积有关,故C不选;
D.溶液的密度与溶液的体积无关,故D选;
故选;BD;
(3)A.配制溶液时要摇匀,应检验容量瓶是否漏液,故A正确;
B.容量瓶为精密仪器,不能用来溶解固体,故B错误;
C.容量瓶为精密仪器,不能用来稀释浓溶液,故C错误;
故选:BC;
(4)a.用量筒量取浓硫酸时俯视观察凹液面,导致量取的浓硫酸体积偏小,溶质硫酸的物质的量偏小,溶液浓度偏低;
b.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水,导致溶液体积偏大,溶液浓度偏低;
故答案为:偏低;偏低.
点评 本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,明确配制原理和操作过程是解题关键,注意误差分析的方法,题目难度不大.


科目:高中化学 来源: 题型:解答题
 某温度(T℃)下的溶液中,c(H+)=10-x mol•L-1,c(OH-)=10-y mol•L-1,x与y的关系如图所示,请回答下列问题:
某温度(T℃)下的溶液中,c(H+)=10-x mol•L-1,c(OH-)=10-y mol•L-1,x与y的关系如图所示,请回答下列问题:| 实验 序号 | Ba(OH)2溶液 的体积/mL | 盐酸的体积/mL | 溶液的pH |
| ① | 22.00 | 0.00 | 9 |
| ② | 22.00 | 18.00 | b |
| ③ | 22.00 | 22.00 | 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑤ | B. | ②③⑥ | C. | ②④⑤⑥ | D. | ②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 400 | 500 | 830 |
| 平衡常数K | 10 | 9 | 1 |
| 实验编号 | 反应物投入量 | 平衡时H2浓度 | 吸收或放出的热量 | 反应物转化率 |
| A | 1、1、0、0 | c1 | Q1 | α1 |
| B | 0、0、2、2 | c2 | Q2 | α2 |
| C | 2、2、0、0 | c3 | Q3 | α3 |
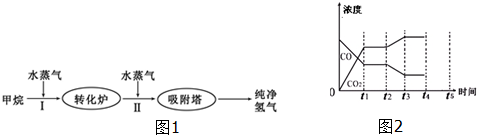
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 负极:Zn,电极反应:Zn-2e-═Zn2+.
负极:Zn,电极反应:Zn-2e-═Zn2+.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有机物CH3-CH2-CH2-CH3的四个碳原子不在一条直线上 | |
| B. | 如果两个有机物互为同系物,则可以推断它们的化学性质相似 | |
| C. | 有机物都是从有机体中分离出来的物质 | |
| D. | 有机物参加的反应较复杂,一般速率慢,常伴有副反应发生 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com