
分析 (1)依据n=$\frac{m}{M}$=$\frac{V}{Vm}$,相同状况下,气体的体积之比等于物质的量之比解答;
(2)依据同周期元素性质递变规律解答;Na、Mg、Al与过量的硫酸反应,在相同状况下产生的氢气的体积相等,某种金属一个原子失去电子数越多,需要的该种金属物质的量越少;
(3)①把金属、非金属分别集中到第三、四章,采用的是分类方法;
②a.胶体具有丁达尔效应;
b.与水反应条件越容易金属单质还原性越强;
c.氧化钠与水反应生成氢氧化钠,过氧化钠与水反应生成氢氧化钠和氧气;
d.图表对比了碳酸钠和碳酸氢钠的性质.
③a.活泼性很强的金属能够与水常温下反应生成氢气;
b.金属单质还原性越强越容易与酸反应产生氢气;
c.依据2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O解答;
d.推理结果是否正确,必须经过实验验证.
解答 解:(1)11g CO2的物质的量为:$\frac{11g}{44g/mol}$=0.25mol;相同状况下同质量的CO2与N2的物质的量之比为:$\frac{m}{44}$:$\frac{m}{28}$=7:11;11.2L(标准状况)某气体物质的量为$\frac{11.2L}{22.4L/mol}$=0.5mol,质量为15g,则该气体的摩尔质量是$\frac{15g}{0.5mol}$=30g/mol;
故答案为:0.25;7:11;30g/mol;
(2)依据同周期元素金属性从左到右,金属性依次减弱,单质还原性依次减弱,所以Na、Mg、Al三种金属的还原性由强到弱的顺序是:Na、Mg、Al;相同条件下生成相同体积的氢气,说明三个反应中转移电子物质的量相等,令转移电子为1mol,根据电子转移守恒,则消耗金属的物质的量之比=$\frac{1mol}{1}$:$\frac{1mol}{2}$:$\frac{1mol}{3}$=6:3:2,
故答案为:6:3:2;
(3)①把金属、非金属分别集中到第三、四章,采用的是分类方法;
故答案为:分类;
②a.丁达尔效应是分散质对可见光散射作用,可见光通过后产生光亮通路的为胶体,故a正确;
b.与水反应越容易,金属的活泼性越强,金属单质还原性越强,故b正确;
c.氧化钠与水反应生成氢氧化钠,过氧化钠与水反应生成氢氧化钠和氧气,所以对比Na2O和Na2O2分别与水反应的产物,可知其相关性质的相同点和不同点,故c正确;
d.教材中在探究Na2CO3和NaHCO3的性质时用到下图所示的表格,使用的是对比的方法,故d正确;
故选:abcd;
③a.已知还原性m>Fe,可知m的还原性强于铁,推理得:虽然铁不能在常温置换水中的氢,但m可能,故a正确;
b.金属单质还原性越强越容易与酸反应产生氢气,b.已知还原性Fe>n,若n为铜,则铜不能与酸反应产生氢气,故b错误;
c.依据2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,可知碳酸氢钠不稳定,碳酸钠稳定,推理得:Na2CO3比NaHCO3热稳定性强,故c正确;
d.推理结果是否正确,必须经过实验验证,故d正确;
故选:b.
点评 本题考查了元素化合物性质,物质的量有关计算,熟悉以物质的量为核心计算公式,明确相关物质的结构与性质是解题关键,题目难度不大.


 名题金卷系列答案
名题金卷系列答案科目:高中化学 来源: 题型:选择题
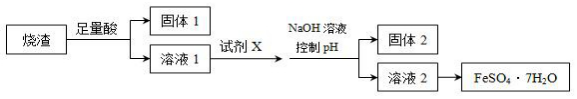
| A. | 溶解烧渣选用足量硫酸,试剂X选用铁粉 | |
| B. | 固体1中一定含有SiO2,控制pH为使Al3+转化为Al(OH)3,进入固体2 | |
| C. | 从溶液2得到FeSO4•7H2O产品的过程中,须控制条件防止其氧化 | |
| D. | 若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4•7H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
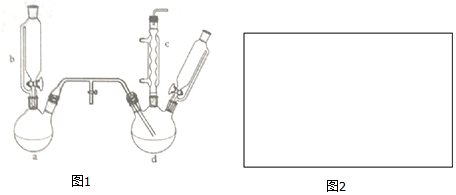
 .
.| 项目 | 二氯苯 | 氯化尾气 | 蒸气 | 成品 | 不确定苯耗 | 合计 |
| 苯流失量(t/kg) | 11.7 | 5.4 | 20.8 | 2.0 | 49.3 | 89.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6:4:3 | B. | 1:1:1 | C. | 2:3:4 | D. | 3:7:6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
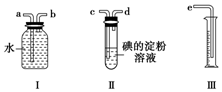 已知SO2+I2+2H2O═H2SO4+2HI,某化学兴趣小组选用下列实验装置,测定工业原料气(含SO2、N2、O2)中的SO2的含量.
已知SO2+I2+2H2O═H2SO4+2HI,某化学兴趣小组选用下列实验装置,测定工业原料气(含SO2、N2、O2)中的SO2的含量.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有② | B. | ②④ | C. | ③④ | D. | ①② |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com