
| A.含有大量NO—3的水溶液中:NH+4、Fe2+、SO2-4、H+ |
| B.在pH=12的溶液中:ClO—、SO2-3、Na+、K+ |
| C.能与铝粉反应生成氢气的溶液中:Na+、Al3+、CH3COOO—、I— |
| D.含有大量HCO—3的澄清透明溶液中:K+、C6H5O—、Cr—、Na+ |
科目:高中化学 来源:不详 题型:单选题
| A.加入铝粉产生H2的溶液中:Fe2+、Na+、SO42-、ClO- |
| B.滴入酚酞显红色的溶液中:NH4+、Mg2+、AlO2-、NO3- |
| C.pH=1的溶液中:Fe3+、Cl-、NO3-、K+ |
| D.c(SO32-)=0.1 mol·L-1的溶液中:Ca2+、MnO4-、SO42-、H+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
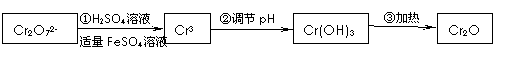
| 有关离子 | Fe2+ | Fe3+ | Cr3+ |
| 完全沉淀为对应氢氧化物的pH | 9.0 | 3.2 | 5.6 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.① | B.② | C.③ | D.④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.NH4+、Al3+、SO42-、NO3- | B.K+、Na+、CH3COO-、SO42- |
| C.K+、MnO4-、NH4+、NO3- | D.Na+、K+、HCO3-、NO3- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.澄清石灰水与足量小苏打溶液混合的离子方程式为:Ca2++OH-+HCO3- |
| B.向2.0mL浓度均为0.1 mol·L-1的KCl、KI混合液滴加1~2滴0.01 mol·L-1AgNO3溶液,振荡,沉淀呈黄色,说明AgCl的Ksp比AgI的Ksp小 |
| C.将体积相同pH均为1的盐酸和醋酸加水稀释至pH为3,盐酸的体积变化大,证明醋酸是弱酸 |
| D.25℃时,pH=4.7,浓度均为0.1 mol·L-1的CH3COOH、CH3COONa混合溶液中。(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Ca2+、NO3-、NH4+、Cl? | B.Na+、SO42-、C1?、Ca2+ | C.H+、Ba2+、Cl?、NO3- | D.Cl?、CO32?、Na+、OH- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 检验,得PH="1" 可知该溶液有强酸性
检验,得PH="1" 可知该溶液有强酸性查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com