
| A. | 已知:2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1,可知CO的标准燃烧热为:566kJ•mol-1 | |
| B. | 含溶质0.5mol的浓硫酸和含溶质1mol的NaOH的稀溶液完全反应放出的热量为中和热 | |
| C. | 氯化钾中混有少量的硝酸钾,可用溶解、蒸发结晶、趁热过滤的方式来提纯氯化钾 | |
| D. | 淀粉和硫酸的混合溶液加热一段时间后,检验水解液中是否有淀粉时,可取少量水解液于试管中,加入足量的强氧化钠溶液处理,最后滴加少量碘水检验是否有淀粉 |
分析 A、燃烧热是指1mol可燃物燃烧释放的热量;
B、浓硫酸稀释过程放出大量的热;
C、氯化钾和硝酸钾的溶解度受温度影响不同,可以根据温度和溶解度的关系进行物质的分离和提纯;
D、碘水可以和氢氧化钠溶液之间发生反应得到两种盐溶液.
解答 解:A、燃烧热是指1mol可燃物燃烧释放的热量,1molCO燃烧放热283KJ,故A错误;
B、含溶质0.5mol的稀硫酸和含溶质1mol的NaOH的稀溶液完全反应放出的热量为中和热,故B错误;
C、氯化钾和硝酸钾的溶解度受温度影响不同,氯化钾溶解度随着温度升高变化不大,但是硝酸钾溶解度随着温度升高而增加,当氯化钾中混有少量的硝酸钾,可用溶解、蒸发结晶、趁热过滤的方式来提纯氯化钾,故C正确;
D、淀粉和硫酸的混合溶液加热一段时间后,检验水解液中是否有淀粉时,可取少量水解液于试管中,加入足量的强氧化钠溶液处理,最后滴加少量碘水会和剩余的氢氧化钠之间反应,无法判断淀粉是否存在,故D错误.
故选C.
点评 本题考查燃烧热的概念、热值计算、焓变与化学计量数的关系、盖斯定律的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ④⑤⑥ | C. | ②③⑤⑥ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3-CH═CH-CH3 二丁烯 | B. | 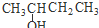 2-羟基丁烷 2-羟基丁烷 | ||
| C. | CH3OOCC2H5 乙酸乙酯 | D. | CH3CH(CH3)CH2COOH 3-甲基丁酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯与溴水混合振荡,水层颜色变浅 | |
| B. | 乙炔与氢气反应变成乙烷 | |
| C. | 乙烯与水在一定条件下反应制取乙醇 | |
| D. | 乙烯与HCl在一定条件下反应制取氯乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由此反应可知:还原性HCl>CrCl3 | |
| B. | 每产生3mol Cl2,实际投入的盐酸要大于14mol | |
| C. | 氧化剂和还原剂的物质的量之比为1:6 | |
| D. | 当转移0.3mol电子时,被氧化的还原剂的物质的量为0.7mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
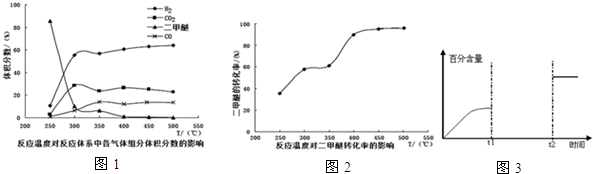
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 被提纯的物质 | 杂质 | 除杂试剂 | 除杂方法 |
| A | CO(g) | CO2(g) | 饱和NaHCO3溶液、浓硫酸 | 洗气 |
| B | FeCl2(aq) | CuCl2 | 铁粉 | 过滤 |
| C | Cl2(g) | HCl(g) | NaOH溶液、浓硫酸 | 洗气 |
| D | NaHCO3(aq) | Na2CO3(aq) | 盐酸 | - |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com