
| A. | PCl5固体是分子晶体 | |
| B. | PCl5固体有良好的导电性 | |
| C. | PCl5晶体由[PCl4]+和[PCl6]-构成,其离子数目之比为1:1 | |
| D. | PCl5晶体由[PCl3]2+和[PCl7]2-构成,其离子数目之比为1:1 |
分析 PCl5在固体状态时,由空间构型分别为正四面体和正八面体两种离子构成,在杂化轨道理论中,正四面体构型的粒子只有AB4型,正八面体只有AB6型,结合该固体状态化学式知,PCl5晶体由[PCl4]+和[PCl6]-构成,据此分析解答.
解答 解:A.PCl5在固体状态时,由空间构型分别为正四面体和正八面体两种离子构成,所以其构成微粒是阴阳离子,为离子晶体,故A错误;
B.离子晶体在熔融状态下能导电,在固体时没有自由移动离子而不能导电,故B错误;
C.在杂化轨道理论中,正四面体构型的粒子只有AB4型,正八面体只有AB6型,结合该固体状态化学式知,PCl5晶体由[PCl4]+和[PCl6]-构成,在离子化合物中,阴阳离子所带电荷相等,所以阴阳离子数目之比为1:1,故C正确;
D.根据C知,PCl5晶体由[PCl4]+和[PCl6]-构成,故D错误;
故选C.
点评 本题考查物质结构性质,侧重考查学生获取信息利用信息解答问题能力,熟悉常见微粒空间构型及该物质中微粒的正确判断是解本题关键,易错选项是C.


 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 1 mol CH≡CH可以与Br2发生加成反应,消耗2 mol Br2 | |
| B. | 苯的邻位二元取代物只有一种可以说明苯分子不具有碳碳单键和碳碳双键的交替结构 | |
| C. | 甲苯(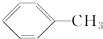 )中所有原子都在同一平面内 )中所有原子都在同一平面内 | |
| D. | 己烷的沸点高于2-甲基戊烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 或
或 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③④ | C. | ③④⑤ | D. | ②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 烃 | CH4 | CH3CH3 | CH3(CH2)2CH3 | 硝基苯酚 |  |  |  |
| 沸点/℃ | -164 | -88.6 | -0.5 | 熔点/℃ | 45 | 96 | 114 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将锌片换成等量的锌粉 | B. | 加入数滴氯化铜溶液 | ||
| C. | 升高温度 | D. | 加入适量的6mol•L-1的硫酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com