
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径(10 | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 最高或最低化合价 | -2 | +2 | +1 | +5,-3 | +7,-1 | +1 | +5,-3 | +3 |
| A. | ⑧号元素为Al | |
| B. | 上述八种元素最高价氧化物对应的水化物⑤号酸性最强 | |
| C. | ②、③处于同一周期 | |
| D. | ④元素的气态氢化物沸点大干⑦元素的氢化物 |
分析 短周期元素,④⑦都有最高价+5、最低价-3,处于ⅤA族,且原子半径④>⑦,故④为P、⑦为N;⑤有+7、-1价,则⑤为Cl;①有最低价-2,原子半径小于N,则①为O;⑧有最高价+3.处于ⅢA族,原子半径小于P,则⑧为B;②有最高价+2,处于ⅡA族,原子半径大于P,则②为Mg;③⑥都有+1价,处于ⅠA族,原子半径③<⑥,且③的原子半径不是最小,故③为Li、⑥为Na,据此解答.
解答 解:短周期元素,④⑦都有最高价+5、最低价-3,处于ⅤA族,且原子半径④>⑦,故④为P、⑦为N;⑤有+7、-1价,则⑤为Cl;①有最低价-2,原子半径小于N,则①为O;⑧有最高价+3.处于ⅢA族,原子半径小于P,则⑧为B;②有最高价+2,处于ⅡA族,原子半径大于P,则②为Mg;③⑥都有+1价,处于ⅠA族,原子半径③<⑥,且③的原子半径不是最小,故③为Li、⑥为Na,
A.由上述分析可知,⑧为B,故A错误;
B.⑤为Cl元素,高氯酸是最高价氧化物对应的水化物酸性最强的酸,故B正确;
C.②为Mg,③为Li,二者处于不同的周期,故C错误;
D.④为P、⑦为N,元素的非金属性越强,其氢化物越稳定,所以稳定性:④<⑦,故D错误,
故选B.
点评 本题考查结构性质位置关系应用,根据化合价与原子半径推断元素是解题关键,注意对元素周期律的掌握,题目难度中等,侧重于考查学生的分析能力和对基础知识的应用能力.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 1.0L1.0mol•L-1的NaAlO2水溶液中含有的氧原子数为2NA | |
| B. | 常温下,0.1mol碳酸钠晶体中含有CO32-的个数为0.1NA | |
| C. | 标准状况下,11.2L18O2中所含中子数为8NA | |
| D. | 25℃时,1LpH=13的Ba(OH)2溶液中含有的OH-数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
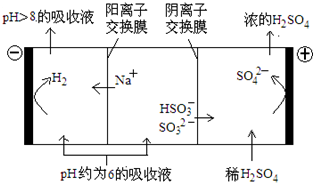
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知甲酸(HCOOH)是羧酸中组成最简单的酸,它具有羧酸的性质,在实验室里常用甲酸在浓硫酸的作用下制取少量一氧化碳,现用甲酸与甲醇反应制取甲酸甲酯来验证甲酸具有能发生酯化反应的性质,装置如图所示.
已知甲酸(HCOOH)是羧酸中组成最简单的酸,它具有羧酸的性质,在实验室里常用甲酸在浓硫酸的作用下制取少量一氧化碳,现用甲酸与甲醇反应制取甲酸甲酯来验证甲酸具有能发生酯化反应的性质,装置如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 验证蔗糖水解产物时,在蔗糖溶液中加几滴稀硫酸,水浴5min,加入新制银氨溶液 | |
| B. | 检验溴乙烷中溴元素时,将溴乙烷和NaOH溶液混合,充分振荡静置后加AgNO3溶液 | |
| C. | 向淀粉溶液中加稀硫酸加热后,加NaOH中和并做银镜反应,检验淀粉是否水解 | |
| D. | 除去苯中混有的少量苯酚,加入浓溴水后过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a+8+m-n | B. | a+16-m+n | C. | a+24-m-n | D. | a+18-m-n |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当A一定时,K值越小,则元素的非金属性越强 | |
| B. | 当K=0,则该元素系同一周期中最活泼的金属元素 | |
| C. | 当n一定时,随着K值增大,则元素的非金属性逐渐增强 | |
| D. | 当K=l时,则该元素系过渡元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某研究性学习小组欲研究影响锌和稀硫酸反应速率的外界条件,下表是其实验设计的有关数据:
某研究性学习小组欲研究影响锌和稀硫酸反应速率的外界条件,下表是其实验设计的有关数据:| 实验 序号 | 锌的质量/g | 锌的 状态 | c(H2SO4)/mol•L-1 | V(H2SO4) /mL | 反应前溶液的温度/℃ | 添加剂 |
| 1 | 0.65 | 粒状 | 0.5 | 50 | 20 | 无 |
| 2 | 0.65 | 粉末 | 0.5 | 50 | 20 | 无 |
| 3 | 0.65 | 粒状 | 0.5 | 50 | 20 | 2滴CuSO4溶液 |
| 4 | 0.65 | 粉末 | 0.8 | 50 | 20 | 无 |
| 5 | 0.65 | 粉末 | 0.8 | 50 | 20 | 2滴CuSO4溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com